19世紀に、炎症イベントとがん進行との関連性に関する最初の知見が報告されました。これらの先の知見をサポートする疫学的、実験的、および臨床的証拠を提供する数多くの報告が劇的に増加してきています。現在、がんの発生におけるリスクファクターとしての慢性炎症の存在に関しては多大な情報が存在しますが、このプロセスを誘導する正確なメカニズムは完全には理解されていません*1。
前がん期は、細胞の成長および生存に必要な経路の活性化をもたらすゲノム異常を特徴とします。微小環境には、急性損傷に対する組織反応に類似するプロセスを介して腫瘍形成表現型をさらにサポートおよび促進する免疫細胞が含まれます。慢性炎症イベントが野放しで、腫瘍微小環境に一貫して存在していると、腫瘍進行(浸潤および転移)が促進されます*2。 新生物の進行は、がん細胞単独の増殖プロセスでは腫瘍の進行を引き起こすのに不十分であるとされてきましたが、それよりもむしろ、炎症細胞、成長因子、活性化間質細胞、およびDNA損傷剤が豊富な微小環境の状況における持続的な増殖に依存しています(図3.1)*3。
※本記事の末尾において、腫瘍関連炎症を評価するための抗体ベースのツールについて体系的に学べる無料コンテンツを紹介しています。
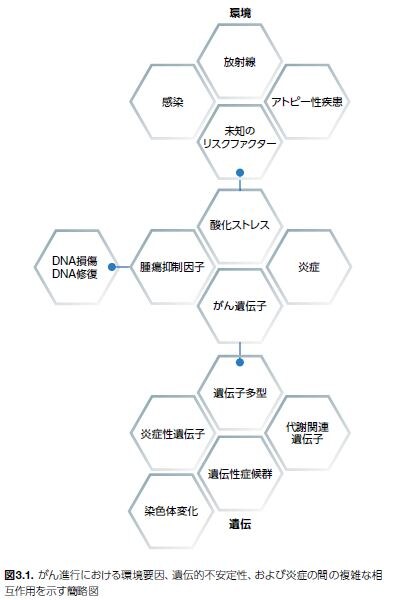
免疫細胞監視の主要な役割の一つは、組織の構造および機能を確実に維持し、病原体から宿主を保護する急性炎症反応を亢進させることです。感染や外傷による侵襲を受けている間、顆粒球が急性炎症部位に動員され、組織の損傷を限局化し、治癒を開始します。マクロファージや他の細胞タイプなどの白血球は、末梢循環から損傷部位に動員され、損傷した細胞およびデブリを除去し、炎症の解決を促進します。線維芽細胞は、細胞外マトリックス沈着に必要とされます。また、血管内皮細胞は、組織修復プロセスに必要とされる血管新生を媒介します。がん進行に関して、免疫細胞の特定の集団が抗腫瘍特性または腫瘍形成促進能を持つことが数人の科学者により明らかにされており、疾患進行は細胞サブセットと可溶性メディエーターのバランス環境に依存すると考えられています。悪性腫瘍は高頻度で慢性的で持続する病的炎症を伴うことが多くの文献で報告されています*2–4。
腫瘍微小環境は、多様な細胞サブセットから構成されています(図3.2)。固形腫瘍におけるがん間質および免疫系に基づくバイオマーカープロファイルについて調べた最近の研究において、がん治療に対する生存および/または反応性と特定の細胞集団の割合との間には正または負の相関性がある可能性が示されました。例えば、ヒト乳がんの調査研究では、がん間質関連線維芽細胞(CAF)は、腫瘍形成微小環境に寄与し、生存と負の相関があることが示されました。これらの細胞は、ケモカイン間質細胞由来因子1(SDF-1、別名:CXCL12)と呼ばれる強力なリンパ球およびマクロファージ走化性因子を産生します。このケモカインのシグナルは受容体CXCR4を介して、腫瘍細胞の増殖、浸潤、および腫瘍血管新生を促進します*5–7。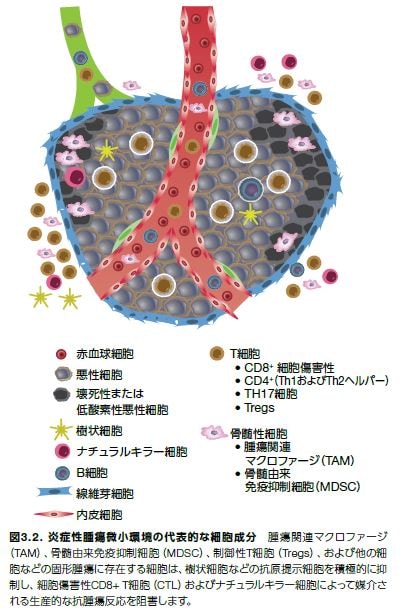
多種多様ながんにおいて、マクロファージの存在は血管密度の増加および低い臨床成績と相関することが数多くの研究で立証されています。腫瘍関連マクロファージ(TAM)の存在は腫瘍増殖をサポートします。さらに、腫瘍特異的CD8+ 細胞傷害性Tリンパ球(CTL)が低レベルであるのに対し、マクロファージおよびCD4+ T細胞が高レベルであるという細胞の特徴はリスクフリーの生存を低減させることが予測されました。また、マウスモデルを用いたさまざまな研究において、乳房のTAMを減少させる操作による腫瘍微小環境の変化は、炎症を促進し、殺腫瘍活性を阻害することで、化学療法に対する反応性を増強し、腫瘍特異的CTLの機能を高める可能性があることが示されています*5。
CD4+ T細胞サブセット
固形腫瘍の中には、いくつかのタイプのT細胞サブセットが存在します(図3.3)。Th1およびTh2サブセットは、最初に同定され、広く特性決定されました。Th1細胞系統は転写因子T-betによって制御されているのに対し、Th2細胞分化にはGATA-3が影響を及ぼします。CD4+ Tヘルパー1(Th1)細胞は、腫瘍血管新生を抑制し、抗原提示細胞(APC)およびNK細胞の動員を介する抗腫瘍特性を持ち、インターロイキン-2(IL-2)やインターフェロンγ(IFN-γ)などのサイトカインを産生することによってCD8+細胞の機能をサポートします。一般的に、Th2細胞は殺腫瘍性好酸球を動員するIL-4およびIL-13̶サイトカインを産生することによって抗腫瘍反応に寄与します。逆に、Th2は、IL-5の分泌を介して腫瘍進行を促進するとされます。Th17細胞は、抗菌性組織炎症に関与するIL-17、IL-21およびIL-22を産生し、多くのがんにおける腫瘍の成長および血管新生をサポートすると一般的に考えられています。FOXP3+ CD4+ Tregは、FOXP3転写因子を発現し、免疫学的恒常性および自己寛容の維持に重要とされます。
制御性T細胞(Treg)は、他のT細胞サブセットを阻害し、腫瘍進行に寛大な関与をしていると考えられます。FOXP3を介するTエフェクター細胞のTregへの分化誘導は、腫瘍微小環境内にTregが多数存在する潜在的な要因として示唆されています。Tregは、他の腫瘍がリンパ球に浸潤する機能を抑制しますが、通常、腫瘍進行に寛容な環境を供給していると説明されます。Tregは、IL-10、トランスフォーミング増殖因子β(TGF-β)の産生、および細胞傷害性Tリンパ球抗原4(CTLA4)の関与を介して免疫反応を抑制することによって、腫瘍細胞を直接殺傷する可能性のあるCD8+T細胞(細胞傷害性Tリンパ球 [CTL]とも呼ばれる)などの殺腫瘍細胞による抗原認識および腫瘍細胞のクリアランスを抑制します*8,9。
イムノアッセイを使用するTh1/Th2サイトカイン痕跡の検出
高品質の一次抗体および二次抗体の幅広いラインアップに加えて、当社では、サイトカインおよび他の目的の可溶性または細胞内タンパク質を検出するための広範なELISAキットを提供しています。感度、精度、および一貫性のある性能を確実するために、当社のELISAキットは、感度、特異性、精度、ロット間の一貫性、回収率、および平行性を含む業界基準に適合することが試験によって保証されています。詳細は、ELISA validation and qualitytesting(ELISAの検証および品質検査)をご覧ください。 当社のヒトおよびマウスサイトカインのマルチプレックス解析用Luminexキットはこちらをご覧ください。
当社のヒトおよびマウスサイトカインのマルチプレックス解析用Luminexキットはこちらをご覧ください。
当記事は、腫瘍関連炎症を評価するための抗体ベースのツールガイドブックからの抜粋です。
ガイドブックは下記から無料でダウンロード頂けます。
細胞傷害性Tリンパ球
T細胞の腫瘍微小環境への漏出、T細胞の複製、および腫瘍内におけるクローン性増殖は、CD8+T細胞の殺腫瘍活性に必要と考えられます。抗原特異的CTLは、標的細胞におけるアポトーシスを誘導するパーフォリン、グランザイム、およびFasリガンド
(FasL)などのタンパク質を産生します(図3.4)。腫瘍細胞の免疫回避には複数の機構が寄与しています。抗腫瘍免疫反応を制限する要因の例としては、これらに限定されませんが、がん細胞の近傍からのエフェクターT細胞の排除、T細胞数の減少、およびT細胞のがん細胞を認識し排除する能力の低下が挙げられます。10 例えば、特定の腫瘍関連マクロファージ(TAM)は、一つの理由としてエフェクターT細胞の機能を抑制する抑制性サイトカインのIL-10を分泌することから、腫瘍原性であると考えられています。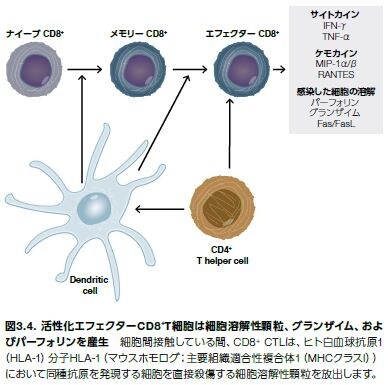 T細胞反応の抑制は、さまざまな抑制性細胞表面分子の発現にも関係します。がん細胞、単球、マクロファージ、および樹状細胞は、活性化T細胞によって発現されるPD-1に関与するプログラム細胞死タンパク質1リガンド1(PD-1L)を発現します。この相互作用は、T細胞増殖、サイトカイン産生、およびCD8+ T細胞における細胞溶解活性を抑制します。トリプトファン代謝の調節は、腫瘍が免疫破壊を回避するもう一つの方法です。この必須アミノ酸は、腫瘍細胞、APC、および骨髄系由来サプレッサー細胞(MDSC)において発現する酵素であるインドールアミン-2,3-ジオキシゲナーゼ(IDO)を必要とするプロセスを介して異化されます。キヌレニンなどのトリプトファン分解産物およびトリプトファンの枯渇によって生じたこの免疫抑制的環境は、腫瘍浸潤リンパ球にアネルギーおよびアポトーシスを誘導します。また、IDOはナイーブT細胞のTregへの分化を促進します*11,12。
T細胞反応の抑制は、さまざまな抑制性細胞表面分子の発現にも関係します。がん細胞、単球、マクロファージ、および樹状細胞は、活性化T細胞によって発現されるPD-1に関与するプログラム細胞死タンパク質1リガンド1(PD-1L)を発現します。この相互作用は、T細胞増殖、サイトカイン産生、およびCD8+ T細胞における細胞溶解活性を抑制します。トリプトファン代謝の調節は、腫瘍が免疫破壊を回避するもう一つの方法です。この必須アミノ酸は、腫瘍細胞、APC、および骨髄系由来サプレッサー細胞(MDSC)において発現する酵素であるインドールアミン-2,3-ジオキシゲナーゼ(IDO)を必要とするプロセスを介して異化されます。キヌレニンなどのトリプトファン分解産物およびトリプトファンの枯渇によって生じたこの免疫抑制的環境は、腫瘍浸潤リンパ球にアネルギーおよびアポトーシスを誘導します。また、IDOはナイーブT細胞のTregへの分化を促進します*11,12。
腫瘍微小環境内では、特定のケモカインの活性もT細胞および他の細胞タイプの蓄積に影響を及ぼします。例えば、腫瘍微小環境内でケモカインは翻訳後修飾されます。一例として、CCL2への窒素の翻訳後付加について説明します。腫瘍近傍は活性酸素種および活性窒素種が豊富で、CCL2の窒素(N-CCL2)は腫瘍間質におけるT細胞の隔離に寄与しますが、腫瘍微小環境内の単球の誘引および集積を促進します*13。
脈管構造はエフェクターT細胞のアクセスも排除していると考えられますが、Tregおよび骨髄性細胞の通過を可能とします。このことは、内皮Fasリガンド(FasL)の発現レベルが上昇した腫瘍に含まれるCD8+ T細胞はわずかですが、Tregは豊富であり、これはc-FLIPの高発現によりFasLを介するアポトーシスに対して保護されているという観察によって支持されます。これらおよび他の免疫回避機構には、免疫療法戦略に対する重要な限界が存在しており、そうでなければ腫瘍特異的T細胞活性が上昇するはずと考えられます*12。
マクロファージおよびがん関連炎症
腫瘍抗原特異的CTLは、抑制性マクロファージサブセットの存在を含む多種多様な機構によって抑制されます(図3.5)。マクロファージサブセットは、腫瘍微小環境内の大部分を占め、多くの異なる機構を介して組織損傷、慢性炎症、および腫瘍進行に寄与します。例えば、骨髄由来免疫抑制細胞(MDSC)は、リンパ器官に動員されると、活性酸素種(ROS)の産生を上方制御します。STAT3を媒介する機構を介して、MDSCはアルギナーゼ1(ARG1)活性を上昇させ、一酸化窒素(NO)レベルを低下させます。CD8+T細胞に対する抗原を提示するプロセスにおいて、特定のROS、特にペルオキシナイトライトは、MDSCによって産生し、T細胞によって発現されるTCRおよびCD8分子のニトロシル化を誘導します。これらのプロセスは同種抗原に反応したT細胞においてアネルギーを誘導します。上方制御されるSTAT1活性は腫瘍部位に遊走するMDSCで検出されており、腫瘍部位において高レベルの誘導型一酸化窒素合成酵素(iNOS)、NO、およびARG1と低レベルのROSを産生します。この状況において、抗原非特異的にCD8+T 細胞機能のMDSC阻害が生じます*14。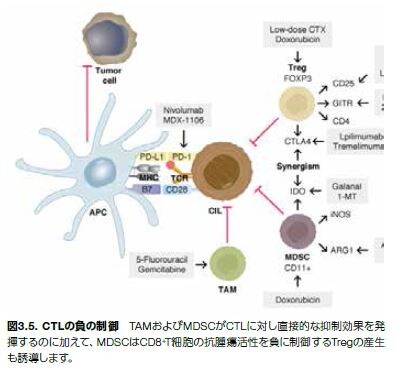
STAT経路およびNF-κB経路を介する転写制御は、MDSCの免疫抑制を仲介します。いったん活性化されると、MDSCはアルギナーゼ1、誘導型NOS(NOS2)、IDO、NADPHオキシダーゼ、ならびに細胞傷害性Tリンパ球、DC、およびNK細胞を抑制する免疫抑制性サイトカインを産生し、Tregの増加をもたらします。腫瘍微小環境内では、MDSCが分化し、腫瘍関連マクロファージ(TAM)となります。TAMは、アルギナーゼ1またはiNOSを、同時にではありませんが上方制御します。TAMは、インターロイキン-1β/ IL-1β、IL-6、IL-10およびトランスフォーミング増殖因子-β(TGF-β)などの抑制性サイトカインの産生を介する非特異的なT細胞の抑制に寄与します。M1 TAMサブセットは腫瘍細胞傷害性に関連するのに対し、M2サブセットは腫瘍進行に関係します(図3.6)*15,16。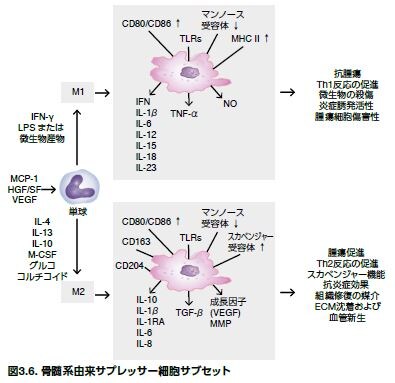 抗体は、免疫蛍光イメージング、免疫組織化学、ウェスタンブロッティング、ELISA、フローサイトメトリー、および他のアプリケーションを含む複数のアプリケーションで使用されています。当社の抗体が優れた実験結果の達成を可能とすることは世界中の多くの文献で実証されています。抗体検索ツールで、目的の研究に適した抗体を見つけるためにはこちらをご覧ください。
抗体は、免疫蛍光イメージング、免疫組織化学、ウェスタンブロッティング、ELISA、フローサイトメトリー、および他のアプリケーションを含む複数のアプリケーションで使用されています。当社の抗体が優れた実験結果の達成を可能とすることは世界中の多くの文献で実証されています。抗体検索ツールで、目的の研究に適した抗体を見つけるためにはこちらをご覧ください。
悪性細胞および非形質転換細胞からなるがん組織は、複雑な腫瘍微小環境を構成します。腫瘍環境には、腫瘍原性と抗腫瘍性の両方の特性を持つT細胞および骨髄サブセットの他、他の数種の白血球、骨髄由来炎症細胞、血管およびリンパ管、線維芽細胞、ならびに脂肪細胞が含まれます*12,17。 さまざまな細胞タイプ、発現される代表的マーカー、およびいくつかの既知の機能に関するアウトラインを表3.2に示します。
サイトカインは、腫瘍微小環境における細胞間コミュニケーションを媒介する低分子量タンパク質です。マクロファージおよびリンパ球などの免疫細胞、ならびに線維芽細胞および内皮細胞などの間質細胞は、細胞分化、成長、生存、遊走、および免疫細胞活性化に関与するサイトカインを放出します。サイトカインは、抗腫瘍活性から細胞形質転換および悪性腫瘍の誘導に至るまで、がん細胞に幅広い影響を与えます。サイトカイン活性の最終結果は、炎症誘発性および抗炎症性のサイトカインのバランス、サイトカイン受容体の発現、ならびに腫瘍微小環境の細胞構成に依存します*18。 腫瘍関連炎症の拡大に一般的に関与するサイトカイン、ケモカイン、および成長因子の重要な特徴を表3.3に示します。
腫瘍成長を抑制する免疫調節剤
過去10年の間、研究者たちは、免疫系の抗腫瘍活性の利用を目的とした数多くの治療アプローチを考案してきました。例えば、さまざまながんに対する治療用および予防用ワクチンの成功の可能性について幅広く試験されています。IL-2などのサイトカインはメラノーマおよび他のがんに対する免疫反応を増強するために処方されており、自己養子CD8+T細胞療法について評価するための複数の臨床試験が進行中で、分子標的T細胞療法を採用する実現可能性について評価することは研究の活動的な領域となっています*19–21。
T細胞は幅広い共刺激受容体を発現します(図3.7)。T細胞活性化を決定する特異的な制御機構について深く理解することが、免疫抑制を阻害し、T細胞を介する抗腫瘍活性を増強する免疫療法用抗体の近年の開発につながっています。2つの新規薬剤ががん治療に新しいパラダイムをもたらしました。近年、チェックポイントタンパクの質CTLA-4およびPD-1の阻害剤がメラノーマおよび非小細胞肺がん(NSCLC)の治療薬としてFDAに承認されました(表3.4)*22–24。
【無料ダウンロード】腫瘍関連炎症を評価するための抗体ベースのツール
当記事は、腫瘍関連炎症を評価するための抗体ベースのツールガイドブックからの抜粋です。以下の内容を含むPDFは下記から無料でダウンロード頂けます。
- 慢性炎症およびがん
- がんドライバー遺伝子および炎症
- 腫瘍微小環境
- シグナル伝達および腫瘍関連炎症
- 要約および付録
【無料ダウンロード】がん研究を促進させる遺伝子解析技術ハンドブック
また、複数のがん研究領域における興味深い最新の発見を可能にする遺伝子解析技術を紹介するハンドブックも配布しています。併せてごらんください。
参考文献:
1. Balkwill F, Mantovani A (2001) Inflammation and cancer: back to Virchow? Lancet 357(9255):539–545.
2. Medzhitov R (2008) Origin and physiological roles of inflammation. Nature 454(7203):428–435.
3. Coussens LM, Werb Z (2002) Inflammation and cancer. Nature 420(6917):860–867.
4. Shiao SL, Ganesan AP, Rugo HS et al. (2011) Immune microenvironments in solid tumors: new targets for therapy. Genes Dev 25(24):2559–2572.
5. Gajewski TF, Schreiber H, Fu YX (2013) Innate and adaptive immune cells in the tumor microenvironment. Nature Immunol 10:1014–1022.
6. DeNardo DG, Brennan DJ, Rexhepaj E et al. (2011) Leukocyte complexity predicts breast cancer survival and functionally regulates response to chemotherapy. Cancer Discov 1(1):54–67.
7. Yang L, Karin M (2014) Roles of tumor suppressors in regulating tumorassociated inflammation. Cell Death Differ 21(11):1677–1686.
8. Kim HJ, Cantor H (2014) CD4 T-Cell Subsets and Tumor Immunity: The Helpful and the not-so-helpful. Cancer Immunol Res 2(2):91–98.
9. Anestakis D, Petanidis S, Kalyvas S et al. (2015) Mechanisms and applications of interleukins in cancer immunotherapy. Int J Mol Sci 16(1):1691–1710.
10. Spranger S, Koblish HK, Horton B et al. (2014) Mechanism of tumor rejection with doublets of CTLA-4, PD-1/PD-L1, or IDO blockade involves restored IL-2 production and proliferation of CD8(+) T cells directly within the tumor microenvironment. Immuno Ther Cancer 2:3.
11. Platten M, Wick W, Van den Eynde BJ (2012) Tryptophan catabolism in cancer: beyond IDO and tryptophan depletion. Cancer Res 72(21):5435–5440.
12. Joyce JA, Fearon DT (2015) T cell exclusion, immune privilege, and the tumormicroenvironment. Science 348(6230): 74–80.
13. Molon B, Ugel S, Del Pozzo F et al. (2011) Chemokine nitration prevents intratumoral infiltration of antigen-specific T cell. JEM 208(10):1949–62.
14. Gabrilovich DI, Nagaraj S (2009) Myeloid-derived suppressor cells as regulators of the immune system. Nat Rev Immunol 9(3):162–174.
15. Sharda DR, Yu S, Ray M et al. (2011) Regulation of macrophage arginase expression and tumor growth by the Ron receptor tyrosine kinase. J Immunol 187(5):2181–2192.
16. Allavena P, Sica A, Solinas G, et al. (2008) The inflammatory micro-environment in tumor progression: the role of the tumor-associated macrophages. Crit Rev Oncol Hematol 66(1):1–9.
17. Balkwill FR, Capasso M, Hagemann T (2012) The tumor microenvironment. Cell Science 125(Pt 23):5591–5596.
18. Landskron G, De la Fuente M, Thuwajit P et al. (2014) Chronic inflammation and cytokines in the tumor microenvironment. J Immunol Res 2014:149185.
19. Johns Hopkins Medicine. http://www.hopkinsmedicine.org/kimmel_cancer_center/centers/breast_cancer_program/breast_cancer_vaccine.html
20. Cancer Research Institute. (2015) Timeline of progress. http://www.cancerresearch.org/our-strategy-impact/timeline-of-progress/timeline-detail
21. The Scientist. (2015) The CAR T-cell race. http://www.the-scientist.com/?articles.view/articleNo/42462/title/The-CAR-T-Cell-Race/
22. Zamarin D, Wolchok JD (2014) Potentiation of immunomodulatory antibodytherapy with oncolytic viruses for treatment of cancer. Mol Ther Oncolytics 1:14004.
23. National Cancer Institute. FDA Approval for Ipilimumab. http://www.cancer.gov/about-cancer/treatment/drugs/fda-ipilimumab. Accessed March 2015.
24. FDA News Release. FDA approves Keytruda for advanced non-small cell lungcancer. http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm465444.htm. Accessed October 2015.
研究用にのみ使用できます。診断目的およびその手続き上での使用はできません。









