Wntタンパク質は、分泌性糖タンパク質のファミリーで、個体発生における多種多様な生物学的プロセスに重要な役割を果たしています。Wntタンパク質は、受容体に結合すると、最終的に細胞運命、増殖および遊走などの細胞プロセスに影響を与える、非常に複雑な連続するシグナル伝達イベントを開始します。Wntシグナル伝達に関連するいくつかのメディエーターにおける遺伝子変異は、遺伝性がんと自然発生がんの両方を引き起こすドライバーとして関与するとされています。
Wntシグナル伝達の制御機構を解明することは、腫瘍形成における十分に確立されたWntの役割を明らかにする活動的な研究領域です。この経路を標的とする新しい治療薬を開発するための研究が進められています。
▼もくじ [非表示]
概要:Wnt経路
健常および疾患におけるWnt の機能
Drosophila(ショウジョウバエ)遺伝子wingless(wg)は、哺乳類のint1遺伝子のオルソログで、マウスにおいて乳がんを誘発する発がん性レトロウイルスであるマウス乳腺腫瘍ウイルス(MMTV)の挿入部位として最初に同定されました。がん原遺伝子のwgおよびint1は、進化的に保存された、無脊椎動物および脊椎動物の初期胚発生に必要とされるWntファミリーのシグナル伝達タンパク質メンバーをコードします(図5.1) *1–3 。中枢神経系、神経堤、および四肢の発生はWnt経路によって制御される正常なプロセスの例であり、Wnt遺伝子の機能を変化させる変異は先天性異常に関連します *3–5 。分泌性糖タンパク質のWntファミリーのメンバーは、シグナル伝達イベントの引き金となり、成人組織の恒常性維持に不可欠で、細胞の増殖、分化、および遊走に関連します *6,7。
Wnt遺伝子は、マウスおよびヒトにおいて19種類のアイソフォームが知られていますが、いくつかのファミリーメンバーの機能を変化させる遺伝子変異に関連する医学的病状を表5.1に示します *8 。
Wnt/β-カテニン経路
シグナル伝達カスケード
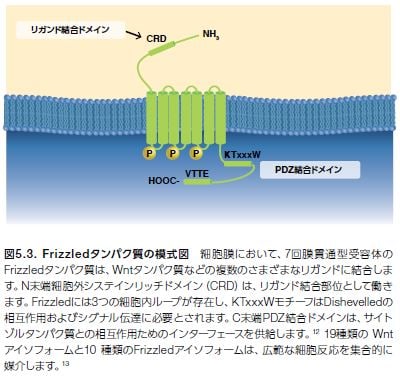
Wntシグナル伝達経路には、古典的経路と非古典的経路が存在します(図5.2)*7。 それぞれのWntシグナル伝達カスケードは、細胞外Wntタンパク質リガンド̶および関連共役受容体(LPR5,6)̶が細胞膜上の7回膜貫通型Frizzled(FZD)受容体に結合すると開始されます(図5.3)。それに続き、膜近傍の細胞質タンパク質Dishevelled(Dvl/Dsh)を介して、Wntシグナルカスケードの下流メディエーターにシグナルが伝達されます *9。
Dvlシグナルは、RhoAおよびROCKなどの細胞質タンパク質を介して、平面内細胞極性(PCP)に伝播します。これは組織の平面における細胞の空間的構成を生じさせるプロセスです。PCPにおける混乱は、秩序が乱れた組織構造を引き起こし、脊椎動物では、神経管欠損および多発性嚢胞腎疾患の発症などの幅広い異常状態に関連します *5 。Dvlもまた、細胞遊走の正の制御因子です。Wnt/β-カテニン経路の制御は複雑で、複数のサイトゾルタンパク質と相互作用する足場タンパク質として機能するDvlを必要とします。
これらのタンパク質は、β-カテニンの正および負の制御因子として機能する、複数の標的遺伝子(その一部はアポトーシスや細胞増殖に関与)の転写を制御する多機能タンパク質です *10。 Dvlは、足場タンパク質としての役割を果たす他に、細胞膜において、細胞内カルシウムやカルシニューリンなどのタンパク質とともにシグナル伝達イベントに関わることによって、細胞運命の決定および遊走に必要とされる活動も促進します *7。
歴史的に、Wnt/β-カテニン経路は、古典的Wnt経路と考えられており、その混乱はがんを含むさまざまな疾患の発症に寄与することが知られています。非古典的Wnt経路̶ PCPシグナル伝達経路およびWnt/Ca2+シグナル伝達経路̶は、生物学的状況によって、β-カテニン非依存的あるいはWnt/β-カテニンシグナル伝達に拮抗して機能すると考えられています。Wnt経路と、増殖因子やサイトカインシグナル伝達経路を調節するような他のシグナル伝達ノード間で高レベルのクロストークが生じていることについては複数のエビデンスが存在します。個々のWntシグナル伝達を活性化するのに必要とされる特別な機構を解明することを目的とした研究が進められています *7,11。
Frizzled受容体
クラスFZD受容体は、Gタンパク質共役受容体の古典的クラスA,B, Cファミリーと関連しています。FZD受容体はWntシグナル伝達に不可欠であることが知られていますが、Wnt–FZD活性化の基本的メカニズムについては明らかにされていません。リガンドの選択性については情報が不足しており、どのようなWnt–FZDの組み合わせによる様式で特異的かつ協調的にWntネットワークの分岐経路における下流イベントに働いているかについてはよく理解されていません *14。
Frizzledファミリーの受容体および他のWnt経路エフェクタータンパク質を検出するための一次抗体および二次抗体ならびにイムノアッセイに関する詳しい情報はこちらをご覧ください。
Dishevelled
Drosophilaを用いた遺伝子実験において、DvlのホモログであるDshは、体および翅毛の方向を維持する役割を持つことが明らかにされました。マウスおよびヒトにおいては、Dvlのアイソフォームが3種類 (DVL1、2および3)存在することが知られています。Dvlタンパク質は、約750アミノ酸から構成され、3分の1のタンパク質ドメイン―N末端のDvl–AXIN(DIX)ドメイン、中央のPDZドメイン、およびC末端のDvl–Egl-10–プレクストリン(DEP)ドメイン―が保存されており、広範な細胞質タンパク質と相互作用します。Dvlは、Wntシグナル伝達経路の正の制御因子および負の制御因子に結合する他に多様なタンパク質アレイと相互作用します(表5.2)*9。
Wntシグナル伝達経路において、Dvlは重合し、Wnt/FZD/LRP5/6シグナロソームのマルチユニットタンパク質クラスターと連携して下流エフェクターへのシグナル伝達を促進します。膜近位の足場タンパク質としての役割に加え、Dsh/Dvlには核輸送配列および核移行配列が含まれ、核における転写機能を媒介している可能性についても研究において示されています *9。
DVLタンパク質を検出するための一次抗体および二次抗体に関する詳しい情報はこちらをご覧ください。
Wnt/β-カテニン活性化機構
Wnt/β-カテニン経路の制御機構は非常に複雑です。β-カテニンは、Drosophila(ショウジョウバエ)属で最初に発見された、一連の核となる発生関連シグナル伝達タンパク質の一部です *15,16 。カテニン(α、β、およびγ)は、Ca2+-依存性細胞間接着を媒介するE-カドヘリンが関与する細胞質タンパク質を遍在的に発現します。カドヘリンタンパク質は、細胞増殖および細胞間接着の制御による上皮細胞層の形成および維持に必要な接着結合の形成に部分的に必要とされます。β-カテニン̶Drosophila アルマジロの哺乳類ホモログ̶はまた、アクチン骨格を繋留し、上皮シートが完成した際に細胞の分化を停止させる接触阻止シグナルを伝達していると考えられます。β-カテニンは、E-カドヘリンとの相互作用の他に、N-カドヘリン、α-カテニンおよび腫瘍抑制因子遺伝子産物APC(大腸腺腫症)などのいくつかの他のタンパク質にも関与しています *17 。古典的Wnt/β- カテニン経路がオン状態において、β-カテニンは、複数のサイトゾルタンパク質と複合体を形成します(図5.4) *15。
オフ状態では、細胞質および核のβ-カテニンのレベルは低く、細胞外Wntの分泌型Frizzled関連タンパク質(sFRP)およびDickkopf(DKK)タンパク質への結合によって、この経路の活性化が妨げられます。Wntリガンドの存在比がFRPやDKKタンパク質などの阻害剤の存在比を上回ると、Wnt/β-カテニンの活性化が生じます。WntがLRP5/6に結合するとともに、FZD受容体を占拠すると、Dvlタンパク質の動員が誘導されます。これらのイベントに続いて、AXINおよび分解複合体が細胞膜に動員され、そこで、AXINの分解およびGSK-3βの阻害がともにサイトゾルβ-カテニン濃度の上昇に寄与します。β-カテニンの蓄積およびその核内移行は、標的遺伝子の転写に必要とされる、DNAに結合するTCF/LEFファミリーメンバーとの相互作用を促進します(図5.5)。β-カテニンの標的遺伝子は、多種多様な細胞タイプおよび組織を制御します。TCF/LEFアイソフォームを選択することによって制御される標的遺伝子の代表例を表 5.3に示します *15。
 APCは、Wnt経路シグナル伝達の重要な制御因子で、conductinを含む構造成分の細胞間結合に関与し、β-およびγ-カテニンの特定の内部領域への結合においてE-カドヘリンと競合します。APCは、活性型β-カテニン–TCF複合体の形成を制御します。APCは、明確になっている腫瘍抑制因子で、APCタンパク質の喪失または減少につながる生殖細胞系列変異は大腸および直腸のがんに関与する家族性大腸腺腫症(FAP)に関連します *18。 APCにおける体細胞変異は、肺、乳房、結腸、直腸、および他の器官の悪性腫瘍にも関連します *19,20。
APCは、Wnt経路シグナル伝達の重要な制御因子で、conductinを含む構造成分の細胞間結合に関与し、β-およびγ-カテニンの特定の内部領域への結合においてE-カドヘリンと競合します。APCは、活性型β-カテニン–TCF複合体の形成を制御します。APCは、明確になっている腫瘍抑制因子で、APCタンパク質の喪失または減少につながる生殖細胞系列変異は大腸および直腸のがんに関与する家族性大腸腺腫症(FAP)に関連します *18。 APCにおける体細胞変異は、肺、乳房、結腸、直腸、および他の器官の悪性腫瘍にも関連します *19,20。
グリコーゲン合成酵素キナーゼ3(GSK-3)は、2種類のアイソフォーム(αおよびβ)を有する多機能セリン/スレオニンプロテインキナーゼで、グリコーゲン代謝における鍵となる酵素として最初に発見されました。その後、GSK-3は細胞分裂、増殖、運動性、および生存において機能することが示されました。GSK-3は、がん、糖尿病、および特定の神経障害などの数多くの病態に関与しています。Wntシグナル伝達経路において、APCおよびGSK-3βはともに足場タンパク質AXINに動員され、β-カテニンの負の制御因子として必要とされます *20,21。
当記事は、がん増殖シグナル伝達経路の探索ガイドブックからの抜粋です。
ガイドブックは下記から無料でダウンロード頂けます。
がんにおけるWnt経路
Wntシグナル伝達の調節不全
がんにおけるWntシグナル伝達の調節不全の役割については十分に立証されており、がんにおけるWnt/β-カテニンシグナル伝達の調節不全につながるさまざまなメカニズムが研究者によって実証されています。APCに関与する機能喪失型変異は、分解複合体の分解、β-カテニンの持続的な蓄積、およびWnt/β-カテニン経路によって制御される標的遺伝子の構成的発現を引き起こします。β-カテニンにおける変異の活性化は、ユビキチン化を介するβ-カテニン分解を妨げ、FZD受容体またはWntリガンドの過剰発現の結果として、無制御な経路の活性化を生じる可能性があります。最終的に、分泌型FZD-関連タンパク質における混乱に関与するWntリガンド阻害の減少は、経路の活性化の増加に寄与すると考えられます *22。
Wnt経路に関する複雑さは、悪性腫瘍の誘発について数多くのエビデンスが明らかにされ、Wnt経路エフェクタータンパク質を標的とする薬剤が開発されています。Wnt経路エフェクタータンパク質を予想通りに調節する能力が好都合であることは実証可能なことですが、研究者は限られた成果しか挙げられていません。その一因として、研究対象の経路を効率的に阻害するための利用可能な薬剤が不足していることが挙げられます。他にもWnt標的療法の開発を困難にするいくつかの要因が存在します *20,22–24。
- 多数のWntリガンドおよび経路-関連タンパク質(i.e., Wntリガンド、DvlおよびFZDタンパク質ならびに他の経路のメディエーター)が存在することから、経路内に機能的冗長性が高い可能性で存在する
- Wnt/β-カテニンカスケード (およびその他の経路との関連性)は遍在し、成体組織に見られる造血幹細胞および幹細胞を含む、体内の数多くの細胞タイプおよび組織を制御している。
- Wnt/β-カテニンシグナル伝達の調節不全は経時的に変化し得る:腫瘍形成初期に生じるWnt依存的なイベントは、腫瘍進行が進むのに従い、Wnt標的に対する感受性を欠如させる方法によって変化すると考えられる
- がんバイオマーカーに関する知識の欠如と、Wnt/β-カテニン阻害の影響を受けると考えられる分子サブタイプに関する理解の欠如が、創薬努力の妨げとなり得る
Wnt/β-カテニン経路が関与する前臨床実験
大多数の前臨床がんモデルでは、恒常的なWnt活性化と腫瘍細胞の進行との関係性が示唆されていますが、相反する報告も存在します。ヒト腫瘍サンプルを解析するいくつかの試験では、Wnt/β-カテニンシグナル伝達の活性化およびβ-カテニンの発現増加と予後改善との相関性が示唆されています。Wntは細胞分化および細胞運命決定に関与することから、一説では、この逆説的な知見は、悪性細胞におけるWnt/β-カテニンシグナル伝達の時間的・空間的な細胞状況は機能的帰結に影響すると考えられるため、Wntシグナル伝達の状況はこの経路が腫瘍抑制または発がん過程のいずれを誘導するかを決定していると考えられます *25。
Wnt/β-カテニン変異を持つ腫瘍を特異的に標的とする承認済みの治療薬は存在しませんが、このカスケードを標的とする実現可能性について検討するための初期の臨床試験が開始されています。例えば、抗FZD7ヒトモノクローナル抗体のバンチクツマブは、進行性固形腫瘍患者を対象とした化学療法との併用について第I相試験が実施されています *26 。同様に、生物学的Wnt阻害剤̶FZD8-Fc融合タンパク質̶については、承認済みの抗がん治療薬との併用療法による固形腫瘍患者を対象とした、第I相用量漸増試験において安全性および有効性の評価が行われています *27,28。
前臨床試験では、限定された化学的化合物の組み合わせにおいて、腫瘍細胞におけるWnt/β-カテニンシグナル伝達の阻害が示されています。より有効な阻害剤を調査する研究試験が継続されており、この複雑な経路の制御機構の理解が進むにつれて、この経路を標的とする新しい治療法が出現するものと考えられます *29,30。
当社は、β-カテニン/Wnt経路のメディエーターを検出するための幅広い一次抗体および二次抗体を提供しています。広範な製品に関する詳しい情報については こちらをご覧ください。
β-カテニンは、細胞間コミュニケーションおよび接着、ならびに場合によっては細胞形態に関与します。核において、β-カテニンは、細胞増殖を促進するサイクリンDおよびc-mycをコードする遺伝子を含む標的遺伝子の転写を促進するLEF/TCF転写因子のファミリーを同時に活性化するように働きます。増殖へのこの影響は、特に、乳房、結腸、肝臓、肺、胃、前立腺、および皮膚の固形腫瘍の腫瘍形成におけるβ-カテニンの役割の分子基盤です *31,32。
【無料ダウンロード】がん増殖シグナル伝達経路の探索ガイドブック
当記事は、がん増殖シグナル伝達経路の探索ガイドブックからの抜粋です。下記の内容を含むPDFは下記から無料でダウンロード頂けます。
~主な内容~
- がん概論
- がん増殖シグナル伝達
- PI3K/Akt/mTORシグナル伝達経路
- Ras/Raf/MEK/ERK(MAPK)シグナル伝達経路
- Wnt/β-カテニン シグナル伝達経路
- 抗体:がん研究のための協力なツール
【無料ダウンロード】がん研究を促進させる遺伝子解析技術ハンドブック
また、複数のがん研究領域における興味深い最新の発見を可能にする遺伝子解析技術を紹介するハンドブックも配布しています。併せてごらんください。
参考文献:
1. Bejsovec A (2006) Flying at the head of the pack: Wnt biology in Drosophila. Oncogene 25(57):7442–7449.
2. Miller JR (2002) The Wnts. Genome Biol 3(1):REVIEWS3001.
3. Nusse R, Varmus HE (1992) Wnt genes. Cell 69(7):1073–1087.
4. Cadigan KM, Nusse R (1997) Wnt signaling: a common theme in animal development. Genes Dev 11(24):3286–3305.
5. Simons M, Mlodzik M (2008) Planar cell polarity signaling: from fly development to human disease. Annu Rev Genet 42:517–540.
6. Clevers H (2006) Wnt/beta-catenin signaling in development and disease. Cell 127(3):469–480.
7. Niehrs C (2012) The complex world of WNT receptor signalling. Nat Rev Mol Cell Biol 13(12):767–779.
8. Nusse R (2014) The Wnt homepage: Human Wnt genes. http://web.stanford.edu/group/nusselab/cgi-bin/wnt/human
9. Gao C, Chen YG (2010) Dishevelled: the hub of Wnt signaling. Cell Signal 22(5):717–727.
10. Olmeda D, Castel S, Vilaró S, Cano A (2003) Beta-catenin regulation during the cell cycle: implications in G2/M and apoptosis. Mol Biol Cell 14(7):2844–2860.
11. Thompson M, Nejak-Bowen K, Monga SPS (2011) Crosstalk of the Wnt Signaling Pathway. In: Gross KH, Kahn M (editors), Targeting the Wnt Pathway in Cancer. New York (NY): Springer. pp 51–80.
12. Schulte G, Bryja V (2007) The Frizzled family of unconventional G protein-couple receptors. Trends Pharmacol Sci 28(10):518–525.
13. Macor JE, editor (2012) Annual Reports in Medicinal Chemistry, Volume 47. San Diego (CA): Academic Press.
14. Dijksterhuis JP, Petersen J, Schulte G (2014) WNT/Frizzled signalling: receptor-ligand selectivity with focus on FZD-G protein signalling and its physiological relevance: IUPHAR Review 3. Br J Pharmacol 171(5):1195–1209.
15. Moon RT, Kohn AD, De Ferrari GV, Kaykas A (2004) WNT and beta-catenin signalling: diseases and therapies. Nat Rev Genet 5(9):691–701.
16. Clevers H, Nusse R (2012) Wnt/ -catenin signaling and disease. Cell 149(6):1192–1205.
17. Thorstensen L, Lothe RA (2003) The WNT signaling pathway and its role in human solid tumors. Atlas Genet Cytogenet Oncol Haematol 7(2):144–159. http://atlasgeneticsoncology.org/Deep/WNTSignPathID20042.html
18. National Library of Medicine (US), Genetics Home Reference website (2012) Familial adenomatous polyposis. http://ghr.nlm.nih.gov/condition/familial-adenomatous-polyposis
19. Virmani AK, Rathi A, Sathyanarayana UG, et al. (2001) Aberrant methylation of the adenomatous polyposis coli (APC) gene promoter 1A in breast and lung carcinomas. Clin Cancer Res 7(7):1998–2004.
20. Polakis P (2012) Wnt signaling in cancer. Cold Spring Harb Perspect Biol 4(5).
21. Luo J (2009) Glycogen synthase kinase 3beta (GSK3beta) in tumorigenesis and cancer chemotherapy. Cancer Lett 273(2):194–200.
22. Voronkov A, Krauss S (2013) Wnt/beta-catenin signaling and small molecule inhibitors. Curr Pharm Des 19(4):634–664.
23. Gurney A, Axelrod F, Bond CJ, et al. (2012) Wnt pathway inhibition via the targeting of Frizzled receptors results in decreased growth and tumorigenicity of human tumors. Proc Natl Acad Sci U S A 109(29):11717–11722.
24. Chien AJ, Dawson DW (2014) Wnt signaling pathways in cancer: a new hope. ASCO Daily News. May 31, 2014. p 4C.
25. Lucero OM, Dawson DW, Moon RT, Chien AJ (2010) A re-evaluation of the “oncogenic” nature of Wnt/beta-catenin signaling in melanoma and other cancers. Curr Oncol Rep 12(5):314–318.
26. ClinicalTrials.gov website (2015) Vantictumab. https://clinicaltrials.gov/ct2/results?term=vantictumab&Search=Search
27. National Cancer Institute (US) website (2015) NCI drug dictionary entry: Fzd8 fusion protein OMP-54F28. http://www.cancer.gov/drugdictionary?cdrid=734935
28. ClinicalTrials.gov website (2015) OMP-54F28. https://clinicaltrials.gov/ct2/results?term=OMP-54F28&Search=Search
29. Liu J, Pan S, Hsieh MH, et al. (2013) Targeting Wnt-driven cancer through the inhibition of Porcupine by LGK974. Proc Natl Acad Sci U S A 110(50):20224–20229.
30. Hitt E (2013) Wnt signaling inhibition: will decades of effort be fruitful at last? OncLive website. http://www.onclive.com/publications/oncology-live/2012/december-2012/wnt-signaling-inhibition-will-decades-ofeffort-be-fruitful-at-last/2
31. Sampson EM, Haque ZK, Ku MC, et al. (2001) Negative regulation of the Wnt-beta-catenin pathway by the transcriptional repressor HBP1. EMBO J 20(16):4500–4511.
32. Polakis P (2007) The many ways of wnt in cancer. Curr Opin Genet Dev 17(1):45–51.
研究用にのみ使用できます。診断目的およびその手続き上での使用はできません。