▼もくじ [非表示]
がん細胞の増殖
遺伝子変異の蓄積は、最終的に細胞周期調節に必要とされるメカニズムを妨げます。正常な状態では、増殖シグナルの産生および伝播ならびに細胞増殖が高度に調節されています。増殖プロセスの厳密な制御は、健全な組織の構造および機能の維持をサポートします。増殖に関連するシグナル伝達経路は、通常、必要になると活性化され、不要になると不活性化されます。
細胞周期調節不全
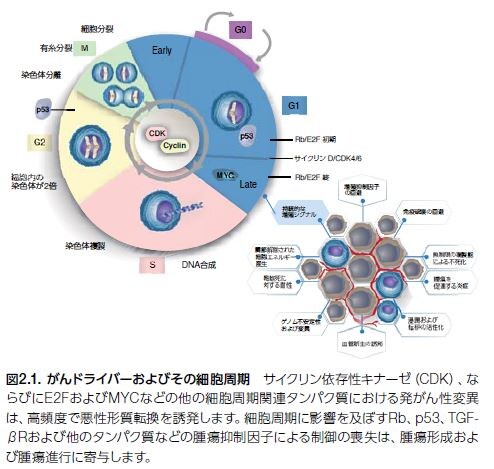
悪性細胞のホールマーク(特徴)の一つは、恒常的調節の喪失および持続的、あるいは制御不能な増殖です。正常なホメオスタシスを維持するために、細胞分裂周期は厳密に制御されています(図2.1)。ヒトがんでは、細胞周期のG1期に調節不全が生じ、そこで細胞は増殖を開始するか、細胞周期から逸脱しG0期の静止状態に入ることが研究者によって確認されました *1–3。
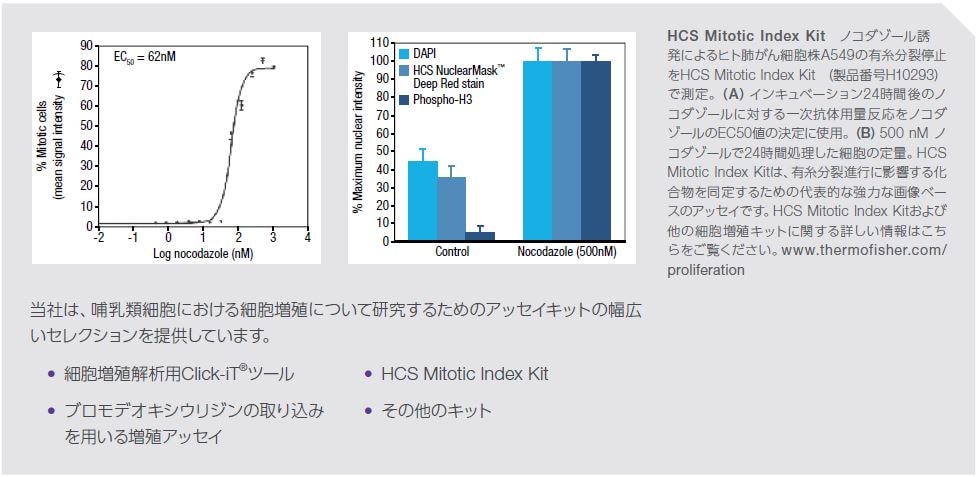
細胞増殖の検出
腫瘍抑制因子TP53をコードする遺伝子における体細胞変異は、ヒトゲノムの他の既知のドライバー遺伝子に影響を及ぼす変異よりも高頻度で発生します。p53シグナル伝達の調節不全は、無制御な細胞増殖を引き起こします。また、TP53における生殖細胞系列の異常は、リ・フラウメニ症候群―さまざまながんの早期発症の素因がある状態―を生じます。p53に関する情報は、1979年に初めて発表され、その数十年後に遺伝子の発がん特性について確認されました *4,5。
当記事は、がん増殖シグナル伝達経路の探索ガイドブックからの抜粋です。
ガイドブックは下記から無料でダウンロード頂けます。
増殖因子経路の調節不全
増殖因子シグナル伝達
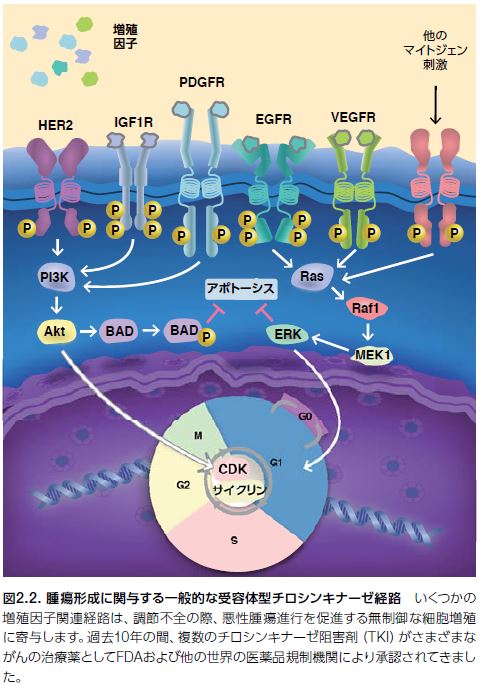
正常細胞および多くの腫瘍において、G1初期は、マイトジェン依存性で、増殖因子の存在を必要とします。一方、G1後期はマイトジェン刺激に依存せずに継続します。しかしながら、一部の腫瘍はリガンド依存性の増殖因子シグナルの非存在下における増殖能を獲得します。腫瘍細胞増殖に関与すると考えられる増殖因子経路の多様性を図2.2に示します *6,7。
上皮成長因子受容体(EGFR)を介する腫瘍細胞シグナル伝達は、リガンド依存性およびリガンド非依存性の受容体活性化機構を介して機能します。例えば、特定のタイプの神経膠芽腫は、EGFRの細胞外ドメインの欠失を抱えているにもかかわらず、構成的活性化型のシグナル伝達を介して発現します *8。
がん増殖および成長の調節不全については、多くの点において明らかにされています *2。
- 腫瘍による増殖因子産生増加の可能性
- 悪性細胞表面における増殖因子受容体数増加の可能性
- 形質転換細胞における受容体構造変化の可能性
- 腫瘍微小環境において産生した増殖因子に対し、がん性細胞が不適切に反応する可能性
- 増殖因子受容体のタンパク質下流の調節不全の可能性
増殖因子受容体経路へのターゲティング
受容体型チロシンキナーゼ(RTK)
通常、増殖因子受容体型チロシンキナーゼの活性化は、リガンドの受容体細胞外ドメインへの結合から始まります(図2.3)。続いて、受容体の細胞質側末端のキナーゼドメインのチロシン残基の自己リン酸化が生じ、細胞増殖および他のプロセスに重要な遺伝子を制御する下流シグナル伝達タンパク質のためのドッキングステーションとして機能します。
上皮成長因子(EGF)は、上皮腫瘍において高発現するタンパク質であるEGFRに結合します。EGFR経路は標的治療のモデルで、実際にがん治療薬の標的としての最初の増殖因子受容体として提唱されました。腫瘍細胞増殖に関与する一般的な増殖因子経路の代表例を表2.1.に示します。がん治療薬として承認されたチロシンキナーゼ阻害剤(TKI)の標的とされている増殖因子受容体は太字で表示しています *7。
がん研究のためのイムノアッセイ
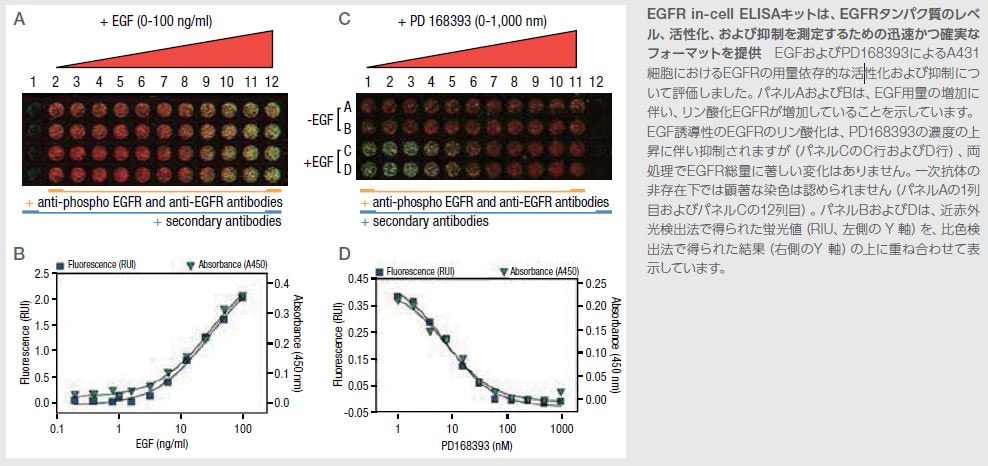
EGFR In-Cell ELISAキット
酵素結合免疫吸着測定法(ELISA)は、タンパク質定量の標準的な手法です。ELISAは、比較的解析が容易で、迅速に結果が得られるため、ハイスループットスクリーニングに対応可能です。当社は、腫瘍学、免疫学、神経生物学、幹細胞研究、および他の分野におけるタンパク質の定量および解析を支援するための幅広い製品を提供しています。
Thermo Scientific™ Pierce™ EGFR Colorimetric In-Cell ELISA Kit(製品番号 62205)に関する詳しい情報はこちらをご覧ください。
また、がん研究および他の研究分野に関連する広範なターゲットを研究するための数百ものELISAキットおよび他のイムノアッセイも提供しています。当社のイムノアッセイに関する詳しい情報はこちらをご覧ください。
がんにおける血管内皮増殖因子シグナル伝達
EGFRなどの受容体型チロシンキナーゼ(RTK)は、長い間、腫瘍細胞増殖との関連性が示唆されてきました。血管内皮増殖因子(VEGF)およびそのRTK、VEGF受容体(VEGFR)は、腫瘍増殖に高頻度で寄与する他のシグナル伝達ネットワークです(図2.4)。しかしながら、VEGFおよびVEGFRは、がんや糖尿病などの疾患に寄与する病的血管新生に関連する異常制御と最も密接に関係しています。
VEGF-AのVEGF受容体2(VEGFR-2)への結合は、Ras/Raf/MAPK/ERK経路およびPI3K/Akt/mTOR経路の活性化を介する内皮細胞の増殖につながります *20 。近年、血管新生およびVEGF経路を阻害する複数の薬剤が、肺、膵臓、腎臓、胃、肝臓、および他の器官の特定のがんに対する治療薬としてFDAおよび他の世界の医薬品規制当局に承認されています。完全には網羅していませんが、VEGF経路を標的とする阻害剤のリストを表2.3に示します。これらの薬剤の大部分はマルチキナーゼ阻害剤であることに注目してください *21 。
研究者たちは、VEGF経路が腫瘍血管新生をサポートするプロセスに極めて重要であることに加えて、VEGF経路シグナル伝達は乳がん細胞株の増殖に直接影響を及ぼす可能性についても報告しています *22。
増殖因子および増殖因子受容体の検出
当社は、VEGFおよびVEGFRファミリータンパク質ならびに他の増殖因子スーパーファミリータンパク質を検出するための幅広い抗体を提供しています。製品に関する詳しい情報は こちらをご覧ください。
トランスフォーミング増殖因子-β
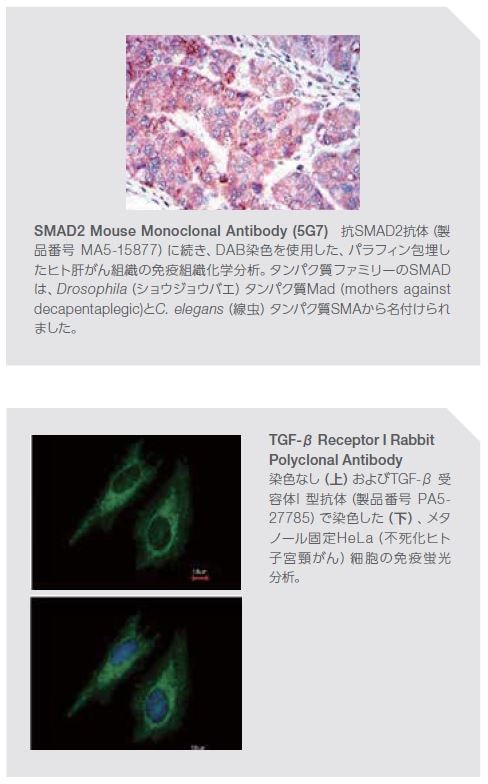
受容体型チロシンキナーゼ経路に加えて、トランスフォーミング増殖因子ファミリーにも、他の主要なシグナル伝達ネットワークが含まれており、それが障害されると、がん細胞の増殖が促進される可能性があります(図2.5)。トランスフォーミング増殖因子(TGF-β)は、構造的にホモ二量体を形成するサイトカインのファミリーです。哺乳類アイソフォームには、TGF-β1、TGF-β2、およびTGF-β3があり、関連するセリン/スレオニン受容体とともに細胞増殖、血管新生、免疫反応、アポトーシス、および他の機能を含む複数の生物学的プロセスを制御しています。TGF-βシグナル伝達の調節不全は、創傷治癒の異常、組織線維化、心血管疾患、がん、自己免疫疾患、および他の障害に関係します。SMADは、進化的に保存された細胞内タンパク質で、セリン/スレオニンキナーゼ受容体によって活性化され、核移行が生じ、それに続きTGF-βシグナル伝達の転写制御因子として機能します *31,32。
がんにおける異常なシグナル伝達
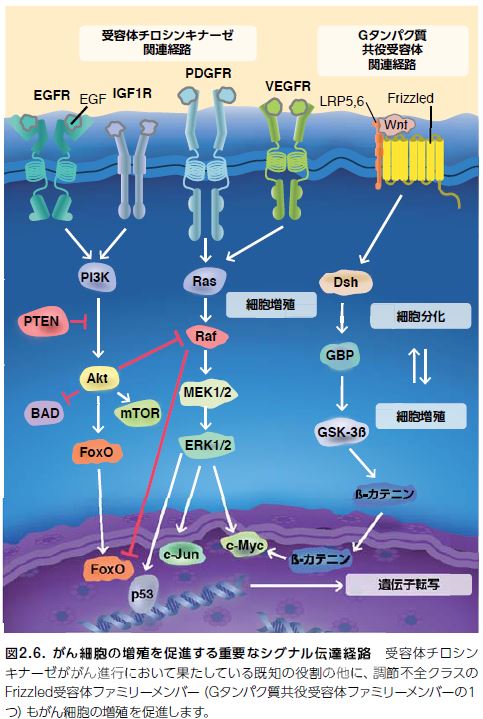
図2.6に示したシグナル伝達カスケードは、正常な細胞プロセスを制御している複数の経路が悪性細胞の増殖にも寄与していることを示しています。成長および増殖に関与する重要な経路には、これらに限定されませんが、PI3K/Akt/mTor、Ras/Raf/MEK、およびWnt/β-カテニンのシグナル伝達経路があります *33–35。
これらの経路は、がんの増殖および成長を制御する他に、集合的に複数の生理的プロセスを調節しています *36 。
- アポトーシス
- 細胞周期調節
- DNAの維持
- 遺伝子転写
- 生存
- 代謝
- 血管新生
- 創傷治癒
- 細胞遊走
- 分化
- その他の機能
抗体:がん研究のための強力なツール
当社では74,000種類以上の一次抗体および二次抗体を提供しております。マルチカラー抗体パネルに必要とされるアプリケーションのためのSpectraViewerについてはこちらをご覧ください。
【無料ダウンロード】がん増殖シグナル伝達経路の探索ガイドブック
当記事は、がん増殖シグナル伝達経路の探索ガイドブックからの抜粋です。下記の内容を含むPDFは下記から無料でダウンロード頂けます。
~主な内容~
- がん概論
- がん増殖シグナル伝達
- PI3K/Akt/mTORシグナル伝達経路
- Ras/Raf/MEK/ERK(MAPK)シグナル伝達経路
- Wnt/β-カテニン シグナル伝達経路
- 抗体:がん研究のための協力なツール
【無料ダウンロード】がん研究を促進させる遺伝子解析技術ハンドブック
また、複数のがん研究領域における興味深い最新の発見を可能にする遺伝子解析技術を紹介するハンドブックも配布しています。併せてごらんください。
参考文献:
1. Chen HZ, Tsai SY, Leone G (2009) Emerging roles of E2Fs in cancer: an exit from cell cycle control. Nat Rev Cancer 9(11):785–797.
2. Hanahan D, Weinberg RA (2011) Hallmarks of cancer: the next generation. Cell 144(5):646–674.
3. Golias CH, Charalabopoulos A, Charalabopoulos K (2004) Cell proliferation and cell cycle control: a mini review. Int J Clin Pract 58(12):1134–1141.
4. Vogelstein B, Prives C (2009) The rise of p53. Nature Publishing Group website. http://www.nature.com/reviews/posters/p53/index.html (second panel)
5. Olivier M, Hollstein M, Hainaut P (2010) TP53 mutations in human cancers: origins, consequences, and clinical use. Cold Spring Harb Perspect Biol 2(1):a001008.
6. Kamal A, Boehm MF, Burrows FJ (2004) Therapeutic and diagnostic implications of HSP90 activation. Trends Mol Med 10(6):283–290.
7. Scaltriti M, Baselga J (2006) The epidermal growth factor receptor pathway: a model for targeted therapy. Clin Cancer Res 12(18):5268–5272.
8. Frederick L, Wang XY, Eley G, James CD (2000) Diversity and frequency of epidermal growth factor receptor mutations in human glioblastomas. Cancer Res 60(5):1383–1387.
9. Li R, Pourpak A, Morris SW (2009) Inhibition of the insulin-like growth factor-1 receptor (IGF1R) tyrosine kinase as a novel cancer therapy approach. J Med Chem 52(16):4981–5004.
10. Ehnman M, Östman A (2014) Therapeutic targeting of platelet-derived growth factor receptors in solid tumors. Expert Opin Investig Drugs 23(2):211–226.
11. Dieci MV, Arnedos M, Andre F, Soria JC (2013) Fibroblast growth factor receptor inhibitors as a cancer treatment: from a biologic rationale to medical perspectives. Cancer Discov 3(3):264–279.
12. National Cancer Institute website (2011) FDA approval for gefitinib. http://www.cancer.gov/cancertopics/druginfo/fda-gefitinib
13. Bristol-Myers Squibb (2013) Erbitux (cetuximab) prescribing information. http://packageinserts.bms.com/pi/pi_erbitux.pdf
14. Genentech (2014) Tarceva (erlotinib) prescribing info. http://www.gene.com/download/pdf/tarceva_prescribing.pdf
15. Amgen (2014) Vectibix (panitumumab) prescribing info. http://pi.amgen.com/united_states/vectibix/vectibix_pi.pdf
16. GlaxoSmithKline (2014) Tykerb (lapatinib) prescribing information. https://www.gsksource.com/gskprm/htdocs/documents/tykerb-pi-pil.pdf
17. Genentech (2014) Herceptin (trastuzumab) prescribing information. http://www.gene.com/download/pdf/herceptin_prescribing.pdf
18. Genentech (2013) Perjeta (pertuzumab) prescribing information. http://www.gene.com/download/pdf/perjeta_prescribing.pdf
19. Genentech (2014) Kadcycla (ado-trastuzumab emtansine) prescribing information. http://www.gene.com/download/pdf/kadcyla_prescribing.pdf
20. Grothey A, Galanis E (2009) Targeting angiogenesis: progress with anti-VEGF treatment with large molecules. Nat Rev Clin Oncol 6(9):507–518.
21. National Cancer Institute website (2011) Angiogenesis inhibitors. http://www.cancer.gov/cancertopics/factsheet/Therapy/angiogenesis-inhibitors
22. Liang Y, Brekken RA, Hyder SM (2006) Vascular endothelial growth factor induces proliferation of breast cancer cells and inhibits the anti-proliferative activity of anti-hormones. Endocr Relat Cancer 13(3):905–919.
23. Genetech (2014) Avastin (bevacizumab) prescribing information. http://www.gene.com/download/pdf/avastin_prescribing.pdf
24. Bayer HealthCare Pharmaceuticals (2013) Nexavar (sorafenib) prescribing information. http://labeling.bayerhealthcare.com/html/products/pi/Nexavar_PI.pdf
25. Pfizer Laboratories (2014) Sutent (sunitinib malate) prescribing information. http://labeling.pfizer.com/ShowLabeling.aspx?id=607
26. GlaxoSmithKline (2014) Votrient (pazopanib) prescribing information. https://www.gsksource.com/gskprm/htdocs/documents/votrient-pi-mg.pdf
27. AstraZeneca (2014) Caprelsa (vandetanib) prescribing information. http://www.caprelsahcp.com/content/dam/physician-services/us/201-caprelsahcp-com/home/caprelsa.pdf
28. Pfizer Laboratories (2014) Inlyta (axitinib) prescribing information. http://labeling.pfizer.com/ShowLabeling.aspx?id=759
29. Sanofi-Aventis (2014) Zaltrap (ziv-aflibercept) prescribing information. http://products.sanofi.us/zaltrap/zaltrap.html
30. Eli Lilly and Company (2014) Cyramza (ramucirumab) prescribing information. http://pi.lilly.com/us/cyramzapi.pdf
31. Samanta D, Datta PK (2012) Alterations in the Smad pathway in human cancers. Front Biosci (Landmark Ed) 17:1281–1293. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4281477/
32. Derynck R, Zhang YE (2003) Smad-dependent and Smad-independent pathways in TGF-beta family signalling. Nature 425(6958):577–584. http://www.nature.com/nature/journal/v425/n6958/full/nature02006.html
33. CancerLink.ru website (2013) New molecular biomarkers candidates for the development of multiparametric platforms for hepatocellular carcinoma diagnosis, prognosis and personalised therapy. http://cancerlink.ru/ennew-molecular-biomarkers-for-hepatocellular-carcinoma-diagnosis.html
34. Le PN, McDermott JD, Jimeno A (2015) Targeting the Wnt pathway in human cancers: therapeutic targeting with a focus on OMP-54F28. Pharmacol Ther 146C:1–11.
35. LoPiccolo J, Blumenthal GM, Bernstein WB, Dennis PA (2008) Targeting the PI3K/Akt/mTOR pathway: effective combinations and clinical considerations. Drug Resist Updat 11(1–2):32–50. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2442829/pdf/nihms51320.pdf
36. Witsch E, Sela M, Yarden Y (2010) Roles for growth factors in cancer progression. Physiology 25(2):85–101.
研究用にのみ使用できます。診断目的およびその手続き上での使用はできません。