マイトジェン活性化プロテインキナーゼ(MAPK)カスケードは、細胞増殖、成長、分化、形質転換およびアポトーシスなどの多種多様な細胞プロセスを制御する複雑なシグナル伝達ネットワークを形成します。MAPK経路のキーメディエーターの調節不全は、腫瘍形成のドライバーとして関与し、がん細胞に以下の能力-マイトジェンシグナルからの独立、増殖シグナル伝達の維持、アポトーシス回避能力、抗増殖シグナルに対する感受性、転移能、および血管新生能-を付与します。MAPK経路の変異が腫瘍促進プロセスに寄与しているという仮定のもと、本経路の阻害剤を開発するための研究に多くの力が注がれています。
▼もくじ [非表示]
概要:MAPKシグナル伝達
主要なMAPK経路の構築
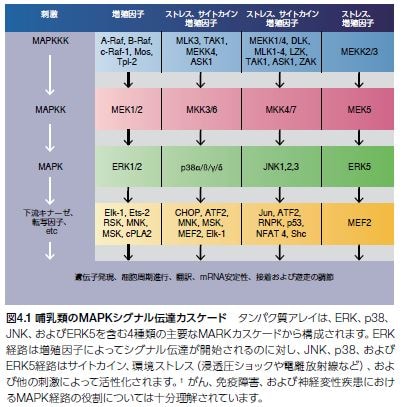
マイトジェン活性化プロテインキナーゼ(MAPK)シグナル伝達のノードは、酵母からヒトにいたる真核生物における増殖、細胞分裂、代謝、運動性、自然免疫、細胞ストレス反応、アポトーシス、および生存機能を含む極めて重要な細胞機能を制御、微調整するための細胞外刺激を伝達し、調節します。MAPK経路には、4種類の主要な分岐経路、および十数種類のMAPK酵素の存在が知られており、少なくとも7種類の異なるグループに分類されます(図4.1)*1–3。
ERK経路は典型的に増殖シグナル伝達に関与する増殖因子によって誘導されるのに対し、JNK、p38、およびERK5経路は主にアポトーシス、増殖阻害、自然免疫、および細胞ストレス反応関連の刺激によって活性化します。これらのそれぞれの古典的MAPKカスケードは、二重特異性セリン/スレオニンプロテインキナーゼ(MAPK、MAPK活性化因子(MEK、MKK、またはMAPK キナーゼ)、ならびにMEK活性化因子(MEKキナーゼ [MEKK]またはMAPKキナーゼキナーゼ)を介する3種類のプロテインキナーゼによる連続的な活性化を特徴とします。古典的MAPK経路の活性化は細胞膜において開始され、そこで低分子量GTPアーゼおよびさまざまなプロテインキナーゼによってMAPKKKがリン酸化されることで活性化されます。続いて、MAPKKKによってMAPKKが直接リン酸化され、活性化されたMAPKKはMAPKをリン酸化します。活性化されたMAPKは、多数の細胞質内基質と相互作用してリン酸化を行い、最終的に状況特異的な遺伝子発現を誘導する転写因子を調節します。この結果、次々に多様な生物学的反応、例えば、浸透圧ショック、細胞周期進行、あるいはインターフェロン産生の誘導が生じます *3,4。
MAPK経路の複雑性
MAPKシグナル伝達カスケードは、シンプルな直線的で一方向性のプロテインキナーゼ群として表されますが、その経路は非常に複雑です。MAPKカスケードおよび他のシグナル伝達ネットワークの中には、程度の大きいクロストークが存在します。例えば、MAPK、PI3Kネットワーク、NFκB、およびJAK-STAT経路のメディエーター間の相互作用については十分に立証されています*1,7。
当社が提供しているMAPKシグナル伝達カスケードについての実験ツールに関する詳しい情報はこちらをご覧ください。
www.thermofisher.com/mapk
当記事は、がん増殖シグナル伝達経路の探索ガイドブックからの抜粋です。
ガイドブックは下記から無料でダウンロード頂けます。
Ras/Raf/MEK/ERK経路の調節
Ras活性化
Rasタンパク質は、HRAS、KRASおよびNRASの3種類のアイソタイプが発見されており、細胞周期進行、細胞移動、アポトーシス、老化、および他の生体機能に関与する多くのシグナル伝達経路に関連する低分子量グアノシントリホスファターゼ(GTPアーゼ)です。Ras活性化の簡単な説明図を図4.3に示します。*8,9–10 SRCは最初のがん遺伝子として同定されていますが、Rasは最初のヒトがん遺伝子として同定されています。また、Rasファミリーメンバーにおける変異はヒト腫瘍の約30%において検出されています*11–13。
多数の細胞表面分子によりRasタンパク質が活性化されると、がんにおける役割が明確となっているRasの主要なエフェクター経路であるRaf/MEK/ERKなどのMAPKカスケードが次々に活性化されます。PI3K/Akt/mTOR経路は、Ras依存性およびRas非依存性のメカニズムによって活性化され、増殖因子およびGタンパク質共役受容体のMAPK経路下流と収束点を共有します*11 。シグナル伝達イベントは、Raf、MEK、およびERK1/2(MAPK1/3とも呼ばれる)を介して導入されるRasによって開始され、核まで伝達されます。そこで、FOS、MYC、ELK、および c-JUNなどの転写因子が制御されることで、細胞増殖および生存に必要な遺伝子発現が調節されます。(図4.2および図4.4)*6,11,14。
当記事は、がん増殖シグナル伝達経路の探索ガイドブックからの抜粋です。
ガイドブックは下記から無料でダウンロード頂けます。
がんにおけるRas/Raf/MEK/ERK経路の役割
Ras活性化のエフェクター
Ras変異は、血液腫瘍および固形腫瘍の両方において同定されています。NRASは、血液腫瘍およびメラノーマにおいて最も高頻度で変異が見られるアイソフォームであるのに対し、KRASは、結腸がんおよび肺がんにおいて高頻度で変異が見られます。完全には網羅していませんが、Ras変異を持つことが知られているヒトがんのリストを表4.1に示します。アイソフォーム特異的なRas変異の頻度および他のMAPK経路の遺伝子を図4.5に示します。これまでにRas阻害剤は開発されていませんが、下流のRas/Raf/MEK/ERKメディエーターについてはいくつかの阻害剤を開発することに成功しています *15–17 。

 当社は、Rasおよび他のがん遺伝子によってコードされるタンパク質を検出するための幅広い抗体を提供しています。広範な製品に関する詳しい情報はこちらをご覧ください。www.thermofisher.com/ras
当社は、Rasおよび他のがん遺伝子によってコードされるタンパク質を検出するための幅広い抗体を提供しています。広範な製品に関する詳しい情報はこちらをご覧ください。www.thermofisher.com/ras
KRAS Rabbit Polyclonal Antibody
製品番号 PA5-27234
アプリケーション:WB、IF、ICC、IHC (P)、IP、ELISA
Rasがん遺伝子ファミリー(そのメンバーは哺乳類肉腫レトロウイルスのトランスフォーミング遺伝子に関係)は、膀胱がん、濾胞性甲状腺がん、および口腔扁平上皮がんなどのさまざまながんに関与しています。Ras変異は、コステロ症候群の原因でもあります。

Ras/Raf/MEK/ERKシグナル伝達の阻害剤
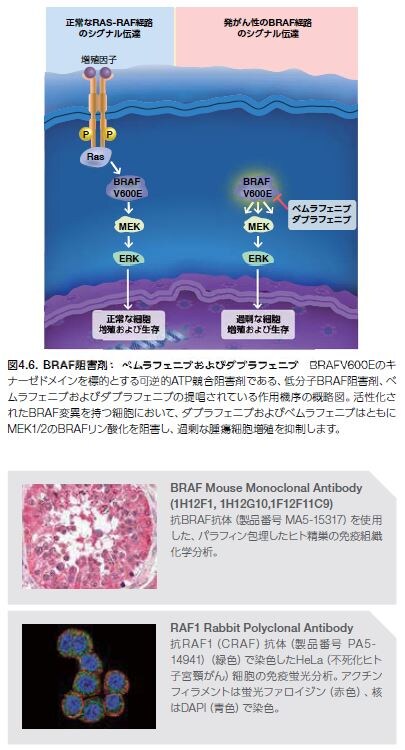
Rasシグナル伝達の下流エフェクターを阻害する薬剤が開発されつつあります。現在、3種類のRas/Raf/MEK/ERK経路阻害剤が医薬品規制機関に承認されています。2種類はBRAFを標的としますが、このMAPKKKは活性型Rasタンパク質の直接的な基質として働きます。3番目の阻害剤は、BRAFの下流で機能するMEKを標的とします(図4.6および図4.7)。
BRAFがん原遺伝子は、ARAF、BRAF、およびCRAF(RAF1とも呼ばれる)の3種類のアイソフォームが知られるRafファミリーメンバーをコードします。これらの高度に保存されたセリン/スレオニンキナーゼは、MAPK [Ras/Raf/MEK/ERK] 経路のメディエーターです。Rafタンパク質は、上流キナーゼRasの基質、およびMEKの直接的な活性化因子として働きます。Rafの過剰活性化は増殖、分化、およびアポトーシスの調節不全につながり、発がん性Ras変異は種々のヒトがんにおいて同定されています。BRAFアイソフォームの変異は、悪性腫瘍̶特に、メラノーマならびに甲状腺がんおよび結腸がんにおいて最も高頻度に認められますが、ARAFやCRASにも発がん性変異は生じます *18。
2002年、一塩基のミスセンス置換(1,799位のヌクレオチドにおけるT→A)によって、BRAFのコドン600においてバリンがグルタミン酸に置換される(V600E)ことが研究者により報告されました。全BRAF変異の80%は高い発がん性を示します。BRAF変異の残りの20%は、V600の近くに位置するエキソンにおいてミスセンス変異が生じています。これらのBRAF変異は、BRAFキナーゼ活性を損なわせる、MAPK経路の持続的な活性化因子です(図4.5)*18,19。
BRAF阻害剤
RasおよびBRAFの変異はいずれも強い発がん性を示し、正常細胞における悪性形質転換を誘導することで知られています。Rasの低分子阻害剤については、これまでの臨床研究で進展がみられていませんが、2種類のBRAF阻害剤―ベムラフェニブおよびダブラフェニブ―については、現在、特定の型のメラノーマ患者を対象とした使用が可能となっています(図4.6)。
ベムラフェニブは2011年に、続いてダブラフェニブは2013年に、V600E変異を有する切除不能または転移性メラノーマに対する治療薬として承認されました。いずれのBRAF阻害剤も、野生型BRAFを有するメラノーマの治療には使用されません *20–23。
BRAF Rabbit Polyclonal Antibody
製品番号 PA5-14926
当社は、BRAFおよびセリン/スレオニンプロテインキナーゼのRafサブファミリーの他のメンバーを検出するための幅広い抗体を提供しています。製品に関する詳しい情報はこちらをご覧ください。www.thermofisher.com/raf
BRAFは、セリン/スレオニンプロテインキナーゼのRafサブファミリーのメンバーであり、細胞膜から核までのマイトジェンシグナル伝達に関与します。BRAFの異常は、肺がんおよび非ホジキンリンパ腫(NHK)などの広範囲のがんに関与します。
MEK阻害
MAPKKs、MEK1およびMEK2は、ERK1およびERK2上のセリン残基およびスレオニン残基を選択的にリン酸化するキナーゼであり、Ras/Raf/MEK/ERKシグナル伝達カスケードの末端キナーゼです。いったん活性化されると、ERK1およびERK2は、細胞周期進行、分化、運動性、代謝、および血管新生などの幅広い細胞プロセスを調節している複数の基質―核および細胞質のリン酸化を触媒します。MEK1およびMEK2キナーゼ遺伝子に遺伝子変異が生じることは稀ですが、原発ヒト腫瘍の解析においてMEK活性の上方制御が頻繁に認められています。トラメチニブは、V600EまたはV600K BRAF変異陽性のメラノーマに対する阻害活性が示されているMEK阻害剤です(図4.7)*16,24–25。
 当社は、MEK1/2および二重特異性プロテインキナーゼファミリーの他のメンバーを検出するための幅広い抗体を提供しています。広範な製品に関する詳しい情報についてはこちらをご覧ください。www.thermofisher.com/mek
当社は、MEK1/2および二重特異性プロテインキナーゼファミリーの他のメンバーを検出するための幅広い抗体を提供しています。広範な製品に関する詳しい情報についてはこちらをご覧ください。www.thermofisher.com/mek
MEK1 + MEK2 Mouse Monoclonal Antibody (J.653.9)
製品番号 MA5-15135
MEK1/2は、マイトジェン活性化プロテイン(MAP)キナーゼキナーゼとして機能する二重特異性プロテインキナーゼファミリーのメンバーです。MAPキナーゼは、細胞外シグナル制御キナーゼ(ERK)としても知られ、複数の生化学的シグナルの統合ポイントとして作用します。これらのキナーゼは、MAPキナーゼシグナル伝達経路の必要不可欠な要素として、増殖、分化、転写調節、および発生などの多くの細胞プロセスに関与しています。
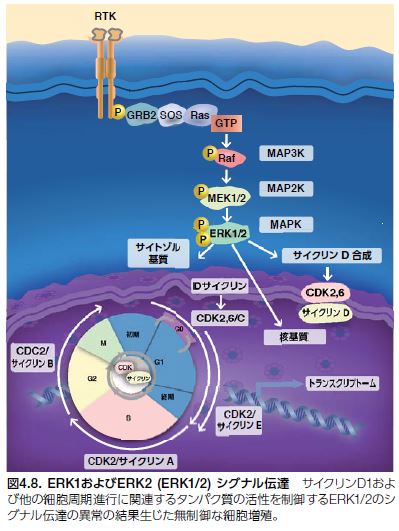
ERK阻害
MAPK ERK1およびERK 2(MAPK3およびMAPK1とも呼ばれる)は、G0/G1期からS期までの細胞周期進行を誘導するセリンおよびスレオニンキナーゼです(図4.8)。ERK1およびERK2(ERK1/2)シグナル伝達は、正の細胞周期制御因子であるサイクリンD1およびc-MYCの活性を調節し、Tob1、FOXO3a、およびp21などの負の制御因子を下方制御します。ERK1/2 MAPキナーゼ経路は、細胞分裂周期における直接的な役割の他に、さまざまな機構によって細胞成長および増殖を制御します。すなわち、ERK1/2は、細胞周期メディエーターを直接調節、タンパク質およびヌクレオチドの合成を促進し、TSC2(ツベルンとも呼ばれる)などのタンパク質との相互作用を介してmTORシグナル伝達を上方制御します *26。
さまざまながん細胞株におけるERK1/2シグナル伝達の低分子による阻害は、ERK1/2の封鎖が細胞周期停止を引き起こし、アポトーシスを誘導することを示します。マウス異種移植片モデルを用いたIn vivo薬理試験においても、MEK1/2低分子阻害剤が腫瘍成長の阻害を促進することが示されています。ERK1/2がRas/Raf/MEK/ERK経路の調節およびさまざまながんモデルにおける着実な前臨床試験結果に重要な役割を果たしているとすると、ERK1/2キナーゼを標的とする薬剤の開発を追求するための強い理論的根拠が存在すると言えます。
 ERK阻害剤については、さまざまながんに対する単独および併用療法について臨床試験が進められています *27–29。
ERK阻害剤については、さまざまながんに対する単独および併用療法について臨床試験が進められています *27–29。
ソラフェニブは、医薬品規制機関による承認済みのERK1/2キナーゼに対する活性を示すRAF阻害剤で、腎臓や肝臓のがん治療に使用されます。しかしながら、ソラフェニブは、複数標的のチロシンキナーゼ阻害剤であるため、ERK1/2活性を下方制御する他に、以下の受容体̶VEGFR、PDGFR、FLT3、RET、およびc-Kitも標的とします(図4.9)*30 。ソラフェニブは数種の異なるタンパク質を標的とするため、いずれのタンパク質を標的としたERK1/2阻害がどの程度ソラフェニブの有効性に寄与しているかは明らかになっていません。選択的ERK阻害剤は開発努力が続けられています *31,32。
 当社は、ERK1/2を検出するための幅広い抗体を提供しています。広範な製品に関する詳しい情報についてはこちらをご覧ください。www.thermofisher.com/erk
当社は、ERK1/2を検出するための幅広い抗体を提供しています。広範な製品に関する詳しい情報についてはこちらをご覧ください。www.thermofisher.com/erk
Phospho-p44 MAPK + p42 MAPK pThr185 + pTyr187 (15H10L7), ABfinity™ Rabbit Monoclonal Antibody
製品番号 700012
ERK(細胞外シグナル制御キナーゼ)は、MAPK(マイトジェン活性化プロテインキナーゼ)としても知られ、密接に関連する44 kDaおよび42 kDaの2つのアイソフォームが存在します。これらのキナーゼは、セリン/スレオニンファミリーに属し、マイトジェン、ホルモン、増殖因子、サイトカイン、および生理活性ペプチドなどの多種多様の刺激で細胞を処理することによって活性化します。細胞刺激は、シグナル伝達カスケードの活性化を誘導し、その下流への影響は細胞成長、分化、および細胞骨格に関係します。ERK1およびERK2は、MEKs(MAPKまたはERKキナーゼ)によりスレオニン残基およびチロシン残基上の活性化ループのThr-Glu-Tyrモチーフ内のリン酸化によって完全に活性化され、それにより、ERK1/2酵素活性が大幅に上昇します。
【無料ダウンロード】がん増殖シグナル伝達経路の探索ガイドブック
当記事は、がん増殖シグナル伝達経路の探索ガイドブックからの抜粋です。下記の内容を含むPDFは下記から無料でダウンロード頂けます。
~主な内容~
- がん概論
- がん増殖シグナル伝達
- PI3K/Akt/mTORシグナル伝達経路
- Ras/Raf/MEK/ERK(MAPK)シグナル伝達経路
- Wnt/β-カテニン シグナル伝達経路
- 抗体:がん研究のための協力なツール
【無料ダウンロード】がん研究を促進させる遺伝子解析技術ハンドブック
また、複数のがん研究領域における興味深い最新の発見を可能にする遺伝子解析技術を紹介するハンドブックも配布しています。併せてごらんください。
参考文献:
1. Roberts PJ, Der CJ (2007) Targeting the Raf-MEK-ERK-mitogen-activated protein kinase cascade for treatment of cancer. Oncogene 26(22):3291–3310.
2. Morrison DK (2012) MAP kinase pathways. Cold Spring Harb Perspect Biol 4(11). pii:a011254.
3. Cargnello M, Roux PP (2011) Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases. Microbiol Mol Biol Rev 75(1):50–83.
4. Schaeffer HJ, Weber MJ (1999) Mitogen-activated protein kinases: specific messages from ubiquitous messengers. Mol Cell Biol 19(4):2435–2444.
5. Keshet Y, Seger R (2010) The Map kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. Methods Mol Biol 661:3–38.
6. Keyse SM (2000) Protein phosphatases and the regulation of mitogen-activated protein kinase signalling. Curr Opin Cell Biol 12(2):186–192.
7. Carracedo P, Pandolfi PP (2008) The PTEN-PI3K pathway: of feedbacks and cross-talks. Oncogene 27(41):5527–5541.
8. Kolch W (2000) Meaningful relationships: the regulation of the Ras/Raf/MEK/ERK pathway by protein interactions. Biochem J 351 Pt 2:289–305.
9. Santarpia L, Lippman SM, El-Naggar AK (2012) Targeting the MAPK-RAS-RAF signaling pathway in cancer therapy. Expert Opin Ther Targets 16(1):103–119.
10. McArthur, GA (2014) The RAS/RAF/MEK/ERK pathway in cancer: combination therapies and overcoming feedback. ASCO Daily News, June 2, 2014. p 38B.
11. Castellano E., Downward J (2011) Ras Interaction with PI3K: more than just another effector pathway. Genes Cancer 2(3):261–274.
12. Martin GS (2004) The road to Src. Oncogene 23(48):7910–7917.
13. Goymer P (2006) (1979) First human oncogene: an important difference. Nature Milestones: Cancer website. http://www.nature.com/milestones/milecancer/full/milecancer17.html
14. Giltnane JM, Balko JM (2014) Rationale for targeting the Ras/MAPK pathway in triple-negative breast cancer. Discov Med 17(95):275–283.
15. National Cancer Institute (US) website (2013) MEK: a single drug target shows promise in multiple cancers. http://www.cancer.gov/cancertopics/research-updates/2013/MEK
16. Cheng Y, Zhang G, Li G (2013) Targeting MAPK pathway in melanoma therapy. Cancer Metastasis Rev 32(3–4):567–584.
17. Der C (2014) Are All RAS Proteins Created Equal in Cancer? National Cancer Institute website. http://www.cancer.gov/researchandfunding/priorities/ras/advance-research/ras-blogs/ras-proteins-createdequal
18. Davies H, Bignell GR, Cox C et al. (2002) Mutations of the BRAF gene in human cancer. Nature 417(6892):949–954.
19. Domingo E, Schwartz S Jr (2004) BRAF (v-raf murine sarcoma viral oncogene homolog B1). Atlas Genet Cytogenet Oncol Haematol 8(4):294–298. http://atlasgeneticsoncology.org/Genes/BRAFID828.html
20. Flaherty KT (2012) Vemurafenib: a first in class serine-threonine protein kinase inhibitor for the treatment of malignant melanoma with activating BRAF mutations. AccessMedicine, McGraw-Hill. http://www.medscape.com/viewarticle/771620
21. Genentech (2014) Zelboraf (vemurafenib) prescribing information. http://www.gene.com/download/pdf/zelboraf_prescribing.pdf
22. GlaxoSmithKline (2013) Tafinlar (dabrafenib) prescribing information. http://www.accessdata.fda.gov/drugsatfda_docs/label/2013/202806s000lbl.pdf
23. Menzies AM, Long GV, Murali R (2012) Dabrafenib and its potential for the treatment of metastatic melanoma. Drug Des Devel Ther 6:391–405.
24. GlaxoSmithKline (2014) Mekinist (trametinib) prescribing information. https://www.gsksource.com/gskprm/htdocs/documents/MEKINIST-PI-PIL.pdf
25. Hilal-Dandan R (2014) Trametinib: a first in class oral MEK inhibitor approved for treatment of metastaticmelanoma with BRAF V600 mutations. AccessMedicine, McGraw-Hill. http://www.medscape.com/viewarticle/822974
26. Frémin C, Meloche S (2010) From basic research to clinical development of MEK1/2 inhibitors for cancer therapy. J Hematol Oncol 3:8.
27. Davies BR, Logie A, McKay JS et al. (2007) AZD6244 (ARRY-142886), a potent inhibitor of mitogenactivated protein kinase/extracellular signal-regulated kinase kinase 1/2 kinases: mechanism of action in vivo, pharmacokinetic/pharmacodynamic relationship, and potential for combination in preclinical models. Mol Cancer Ther 6(8):2209–2219.
28. Wong DJ, Robert L, Atefi MS et al. (2014) Antitumor activity of the ERK inhibitor SCH722984 against BRAF mutant, NRAS mutant and wild-type melanoma. Mol Cancer 13:194.
29. ClinicalTrials.gov website (2015) Selumetinib. https://clinicaltrials.gov/ct2/results?term=Selumetinib
30. Wilhelm S, Carter C Lynch M, et al. (2006) Discovery and development of sorafenib: a multikinase inhibitor for treating cancer. Nat Rev Drug Discov 5(10):835–844.
31. Liu L, Cao Y, Chen C et al. (2006) Sorafenib blocks the RAF/MEK/ERK pathway, inhibits tumor angiogenesis, and induces tumor cell apoptosis in hepatocellular carcinoma model PLC/PRF/5. Cancer Res 66(24):11851–11858.
32. Morris EJ, Jha S, Restaino CR et al. (2013) Discovery of a novel ERK inhibitor with activity in models of acquired resistance to BRAF and MEK inhibitors. Cancer Discov 3(7):742–750.
研究用にのみ使用できます。診断目的およびその手続き上での使用はできません。