Trypsin-EDTAは接着細胞の解離操作に汎用されている試薬です。タンパク質分解酵素であるTrypsinが細胞接着分子を消化し、EDTAが細胞接着に必要なCa2+とMg2+をキレートして細胞の解離を促進します。一般にTrypsinはブタなどの膵臓から精製したものを原材料とするため、膵臓に存在するTrypsin以外の消化酵素の残存が避けられず、これが細胞毒性につながる可能性があります。この問題の解決策として、当社は独自の細胞解離試薬「TrypLE試薬シリーズ」を提供しています。この試薬は、Trypsinと同じくリジンとアルギニン残基のC末側を切断する酵素とEDTAを含んでおり、Trypsin-EDTAの代わりに使用できます。細菌に産生させた組み換え酵素を原料としているため、Trypsin-EDTAで懸念される夾雑酵素が含まれていないことから、Trypsin-EDTAと比べて細胞に”やさしい”酵素だと言われています。以前の記事で、過剰なTrypsin処理が細胞の生存率や生細胞数に及ぼす影響を確認しました(関連記事:【やってみた】細胞をTrypsinで処理しすぎてみた)。そこで今回は細胞をTrypLE試薬で過剰に処理して、生存率や細胞数への影響を検証しました。
実験方法
■細胞
HeLa細胞の懸濁液
■手順
- 細胞懸濁液を遠心分離
- 上澄みをアスピレートしてGibco™ DPBS(製品番号 14190144)で再懸濁
- 細胞懸濁液を遠心分離
- Gibco™ CTS™ TrypLE™ Select Enzyme(製品番号 A1285901)で再懸濁
- 5本のチューブに小分け
- 37℃の温浴で10、20、30、60分間インキュベート
- Gibco™ Trypan Blue溶液(製品番号 15250061)と細胞懸濁液を1:1で混合してInvitrogen™ Countess™ Chamber Slide(製品番号 C10283)に注入
- Invitrogen™ Countess 3 FL自動セルカウンターの明視野モードで自動セルカウント
※細胞の破片はパラメーター調節機能で除外
過剰なTrypLE処理が細胞の生存率に及ぼす影響
さっそく結果を見ていきましょう。HeLa細胞をTrypLE試薬で懸濁した溶液を37℃で0、10、20、30、60分間インキュベートしたときの生存率を図1にまとめました。
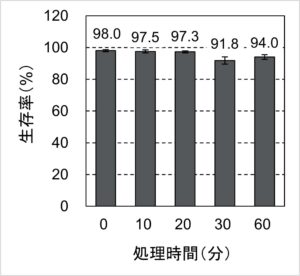
図1. 過剰なTrypLE処理の生存率への影響
Trypsinで過剰に処理した検証では処理30分後には生存率が大きく低下しました(関連記事:【やってみた】細胞をTrypsinで処理しすぎてみた)。一方今回のTrypLEでは、30分後と60分後の生存率がわずかに低下傾向ではあるものの、90%以上の生存率を維持していました。これは、TrypLEがTrypsinよりも“やさしい”ことのあらわれなのでしょうか?それを確かめるために、生細胞の濃度の継時変化を図2にまとめました。
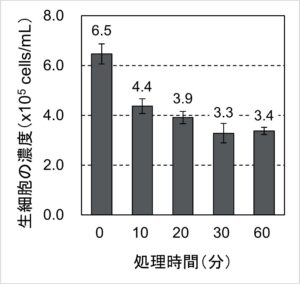
図2. 過剰なTrypLE処理の生細胞濃度への影響
生細胞の濃度は最初の10分間の処理で3割以上低下し、その後も徐々に低下する傾向が見られました。つまり、細胞に”やさしい”とされるTrypLEであっても、過剰な処理は細胞に悪影響があることが確かめられました。生存率を指標にすると影響が軽微に見えるにもかかわらず(図1)、生細胞の濃度としては顕著に影響を受けている(図2)のは興味深いです。これはCountessによる自動セルカウントとTrypan Blueによる生死判定の原理が関係していると考えられます。過剰なTrypLE処理によって損傷した細胞がすみやかに破片になっていると仮定すると、Countess自動セルカウンターによるカウントの対象外となって死細胞率を上昇させずに生細胞の濃度が低下することになります。今回の結果は、何らかの処理が細胞の生死に与える影響を判断する際には、Trypan Blueの生死判定だけでなく細胞の濃度(細胞数)も確認したほうがよいことを示唆しています。
過剰なTrypLE処理の細胞の増殖への影響
最後に、各処理条件が細胞のその後の増殖に影響を与えるかどうかを確認するため、細胞培養プレートに播種して培養3日間培養しました。それぞれの生細胞の数を測定した結果を図3にまとめました。
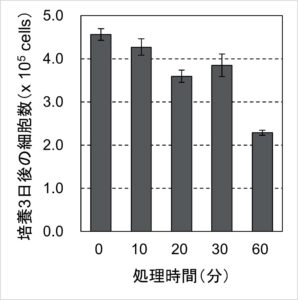
図3.過剰なTrypLE処理による細胞増殖への影響
TrypLE処理の時間が長くなるにつれて生細胞数が減っていく傾向がみられましたが、処理0分から処理30分の減少率と比較して、処理30分から処理60分の方が大きく減少しました。図2の結果から、処理30分と60分のサンプルのプレート播種時の生細胞数はほぼ同等だったことから、Trypan Blueによる生死判定では検出できないダメージを処理60分の細胞は30分の細胞よりも強く受けていたと考えられます。細胞の表面には細胞接着に関わる分子以外に、外部からの増殖因子を受け取る受容体分子など、さまざまな機能の分子が存在しています。この結果は、消化された細胞表面分子の数の差の反映なのかもしれません。培養3日後の細胞の状態を観察すると、処理60分の細胞ではプレートの底面に接着しきれていない細胞が散見され、処理0分や30分と比べてもダメージが残っているように見えました。
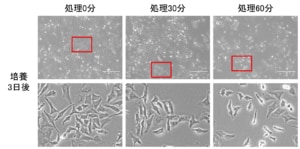
図4. 過剰なTrypLE処理による細胞の増殖や接着への影響
まとめ
今回は、Trypsin-EDTAのかわりとなりうる細胞解離試薬「TrypLE Select Enzyme」で細胞を過剰に処理し、細胞の生存やその後の培養への影響を検証しました。夾雑酵素が無いためTrypsinよりも”やさしい”とされるTrypLE Select Enzymeですが、過剰な処理はやはり細胞にダメージを与えることが確認できました。ご使用の際には、Trypsin-EDTAの場合と同様に、細胞の解離に必要な最小限の処理の処理としてください。
TrypLE Select Enzymeは細胞への作用以外にも、非常に安定性が高いことから室温保存が可能なところもTrypsin-EDTAよりも便利なポイントです。もちろん冷蔵、冷凍保存も可能です。今回の実験は「Gibco™ CTS™ TrypLE™ Select Enzyme」を使用しましたが、このほかにも「Gibco™ TrypLE™ Express Enzyme」、「Gibco™ TrypLE™ Select」を提供しています。試薬に含まれる酵素の性能は同等ですので、今回の検証結果はこれらの試薬すべてに当てはまります。TrypLEシリーズの特長とラインナップについては、関連記事「シングルセル解析や初代培養に使われる細胞解離試薬の選択ガイド」にまとめられていますのでご参照ください。
細胞の継代やセルカウントについてもっと知りたい方は無料オンラインセミナー「これから始める人は必見!細胞培養のキホンのキ」、「いまさら聞けない!細胞カウントを基本から学ぼう」や講義と実習で細胞培養の基本を習得できる細胞培養ハンズオントレーニング(1日コース、2日間コース)の受講をご検討ください。これらのトレーニングの内容の違いについては関連記事「細胞培養関連の学習リソースまとめ~トレーニング・セミナー・ハンドブックなど~」を参考にしてください。今回の内容に限らず、細胞培養関連の製品・アプリケーションなどでご不明点がありましたらテクニカルサポート(jptech@thermofisher.com)へお気軽にお問い合わせください。
Gibco細胞培養ハンドブックダウンロード(2021年リニューアル版)
研究用にのみ使用できます。診断用には使用いただけません。