はじめに
培養細胞の汚染(コンタミネーション)は、細胞培養実験室において生じる問題の中では、間違いなく最も一般的な問題であり、時には非常に深刻な結果を引き起こします。培養細胞を汚染する物質は、培地、血清、および水中の不純物、エンドトキシン、可塑剤および洗剤などの化学的汚染物質と、細菌、かび、酵母、ウイルス、マイコプラズマ、ならびに他の細胞系による相互汚染などの生物学的汚染物質という、2つのカテゴリーに大きく分類できます。汚染を完全に排除することは不可能ですが、汚染源を完全に理解し、優れた無菌操作を実行することにより、汚染の頻度と程度を軽減させることは可能です。今回は、主なタイプの生物学的汚染に関する概要をご紹介します。
コンタミの種類
細菌
細菌は、単細胞性微生物の巨大かつどこにでもいる一群です。一般的には、直径が数μmの大きさで、形状は球形、桿状、らせん状など様々です。細菌は、その遍在性、大きさ、および速い成長速度のため、酵母およびカビとともに、細胞培養において最も一般的に遭遇する生物学的汚染物質です。
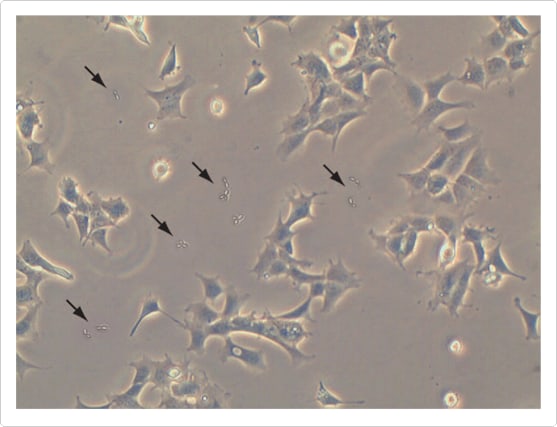
細菌による汚染は、培養細胞の目視検査により、細菌感染してから数日で容易に検出されます。細菌に感染した培養物は、一般的には曇って(濁って)見え、表面に薄い膜が観察されることもあります。培地のpHの突然の低下もしばしば観察されます。低倍率の顕微鏡下では、細菌は、細胞間で動いている小さな顆粒のように観察され、高倍率の顕微鏡で観察すると、個々の細菌の形を判別できます。下の画像は、大腸菌で汚染された接着性293培養細胞を示しています。
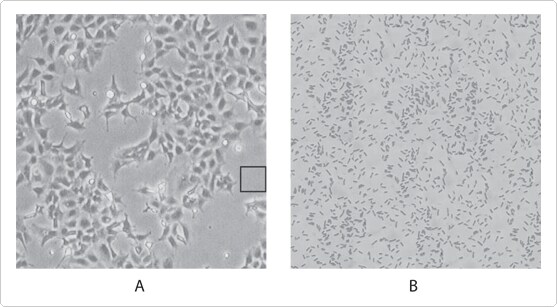
図1 大腸菌で汚染された、接着性293培養細胞のシミュレーション済み位相コントラスト画像。低倍率の顕微鏡下では、接着性細胞間に、微小の揺光性の顆粒が見られますが、個々の細菌は識別が困難です(パネルA)。黒の四角で囲んだ部分をさらに拡大すると、概して桿状で、長さ約2 μm、直径約0.5 μmの、個々の大腸菌細胞が解像されます。パネルA中の、黒の四角の各辺は100 μmです。
酵母
酵母は、菌界に属する単細胞性真核微生物で、その大きさは数μm(一般的)から40 μm(まれ)の範囲に及びます。細菌による汚染と同様に、酵母によって汚染された培養物は、特に汚染が進むと濁って見えます。酵母に汚染された培養物のpHは、汚染が重度に進行するまでは殆ど変化しませんが、汚染が進むと一般に上昇します。顕微鏡下では、個々の酵母が卵形または球形の粒子として観察され、さらに小さい粒子を出芽する場合もあります。下の画像は、播種後24時間の、酵母によって汚染された接着性293培養細胞を示しています。
カビ
カビは、菌界に属する真核微生物で、菌糸と呼ばれる多細胞性のフィラメントとして成長します。この多細胞性のフィラメントが連結したネットワークは、遺伝的に同一の核を含み、コロニーまたは菌糸体と呼ばれています。酵母による汚染と同様に、汚染の初期においては培養物のpHは安定状態を保ちますが、汚染がより重度に進行するとpHは急激に上昇し、培養物が濁ってきます。顕微鏡下では、菌糸体は通常、薄く細いフィラメント状に見えますが、より密集した胞子の塊として観察されることもあります。多くの種のカビの胞子は、極めて厳しい成育に適さない環境を休眠状態で生き延び、成長に適した環境が訪れた時にのみ活性化されます。
ウイルス
ウイルスは、微視的な感染性物質であり、宿主細胞の機構を利用して再生します。その極めて微小な大きさのゆえに、培養物中での検出、および細胞培養実験室で使用される試薬からの除去は大変困難です。大部分のウイルスは、宿主に対する要求性が非常に高く、一般に宿主以外の種の細胞培養に悪影響を与えることはありません。しかし、ウイルスに感染した細胞培養物を使用することは、特にヒトまたは霊長類の細胞が実験室で培養されている場合には、実験従事者に重大な健康危害をもたらす可能性があります。細胞培養物のウイルス感染は、電子顕微鏡観察、抗体を用いた免疫染色、ELISA分析、または適切なウイルスに対応したプライマーを用いたPCR法によって検出することが可能です。
マイコプラズマ
マイコプラズマは、細胞壁を有しない単純細菌で、自己増殖可能な最小の微生物であると考えられています。マイコプラズマはその極めて小さなサイズ(通常1 μm未満)のため、極めて高密度に成長し、細胞培養物を劣化させるようになるまで検出することは困難で、そのような状態になるまで、感染の視覚的徴候が全く見られないことがしばしばあります。成長速度の遅いマイコプラズマのいくつかは、細胞死を引き起こすことなく、細胞培養物中に存在し続けることもあります。しかし、その場合でも、培養物中の宿主細胞の活動や代謝を改変する可能性があります。慢性的なマイコプラズマ感染は、細胞増殖の速度の低下、飽和密度の低下、浮遊培養物の凝集として現れることもありますが、マイコプラズマ感染を検出する唯一確実な方法は、培養物を定期的に、蛍光染色(例: Hoechst33258)、ELISA、PCR、免疫染色、オートラジオグラフィーまたは微生物学的アッセイを用いて検査することです。

図3 マイコプラズマ感染していない培養細胞(パネルA)、およびマイコプラズマに感染した培養細胞(パネルBおよびC)の顕微鏡写真。培養物の試験には、Invitrogen™ MycoFluor™マイコプラズマ検出キットを使用し、キット添付のプロトコールに従って検出を行いました。固定細胞においては、MycoFluor™ 試薬は細胞核に導入され、細胞核を強く染色しますが、蛍光性の核外物質が存在しないことから、培養物はマイコプラズマで汚染されていないことが示唆されます(パネルA)。マイコプラズマに感染した固定細胞においては、MycoFluor試薬は細胞核およびマイコプラズマの両者を染色します。核の上または近くに存在するマイコプラズマは、染色された核の強い相対蛍光のために不明瞭ですが、明るい核から離れて存在するマイコプラズマは、容易に観察できます(パネルB)。生細胞においては、MycoFluor試薬は細胞核に導入されませんが、細胞外に存在するマイコプラズマは容易に染色されます(パネルC)。これらの顕微鏡写真は、365 nmでの励起、100/1.3 Plan Neoflaur™(Zeiss)対物レンズおよび450 ± 30 nmのバンドパスフィルターを使用して取得したものです。
相互汚染(クロスコンタミネーション)
微生物汚染ほど一般的ではありませんが、多くの細胞系において、HeLa細胞やその他の成長速度の速い細胞系との広範囲に及ぶ相互汚染は、明確に認められている問題であり、甚大な被害をもたらします。相互汚染を避けるためには、信頼できる細胞バンクから細胞系を入手し、細胞系の特性を定期的に検査し、無菌操作を徹底させることが有益です。使用している細胞系の相互汚染の有無は、DNA指紋法、核型分析およびアイソタイプ分析によって確認することが可能です。
抗生物質の使用
細胞培養においては、抗生物質は定期的に使用されるべきではありません。その理由は、抗生物質の連続的な使用が、抗生物質耐性株の発生を促し、汚染が低レベルで持続し(抗生物質が培地から除かれた場合に全面的な汚染へと発展する危険性があります)、さらにマイコプラズマ感染やその他の潜在性の汚染を隠蔽する可能性があるためです。その上、いくつかの抗生物質は細胞と相互作用し、研究中の細胞内プロセスを妨害する可能性があります。
抗生物質は、最後の手段として短期間に限り使用し、できる限り速やかに培養物から除去することが必要です。抗生物質を長期にわたり使用する場合には、抗生物質を含まない培養物を、潜在性感染の対照として、同時に維持することが必要です。
【無料ダウンロード】Gibco細胞培養基礎ハンドブック
細胞培養に関する基礎情報を解説したハンドブックをご用意しています(日本語版、約100ページ)。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
研究用にのみ使用できます。診断用には使用いただけません。