▼もくじ [非表示]
はじめに
細胞膜は、タンパク質が埋め込まれたリン脂質二重膜から構成され、正味の負電荷を持ちます。このように、細胞膜はDNAやRNAのリン酸骨格のような同じく負に荷電している巨大分子を通過させないためのバリアとして存在しています。これまで、核酸の細胞膜通過を可能とするために、化学物質や担体分子を用いて核酸をコーティングして中和する化学的手法から、DNAを直接細胞に導入するために膜上に一時的に孔を開ける物理的手法まで、各種様々なアプローチを用いた数多くの技術が開発されてきました。
現在使用可能なトランスフェクション技術は、以下の3種類に大きく分類されます。化学的手法は、担体分子を用いて負に荷電した核酸を中和するか正電荷を付与する手法、生物学的手法は、遺伝子組換えウイルスを介して非ウイルス遺伝子を細胞に導入する手法(別名: 形質導入)、そして物理的手法は、細胞の細胞質または核に核酸を直接送達する手法です。しかしながら、これらの手法の中で全ての細胞および全ての実験に適合するものはありません。そのため、細胞タイプおよび実験ニーズに応じて、トランスフェクション効率が高く、細胞毒性が低く、正常な生理機能への影響が最小限となる、簡便で再現性の高い理想的なアプローチを選択する必要があります(Kim and Eberwine, 2010)。
今回は遺伝子導入方法における化学的手法、生物学的手法、物理的手法をまとめましたのでご紹介します。
化学的遺伝子導入法
カチオン性脂質媒介性導入
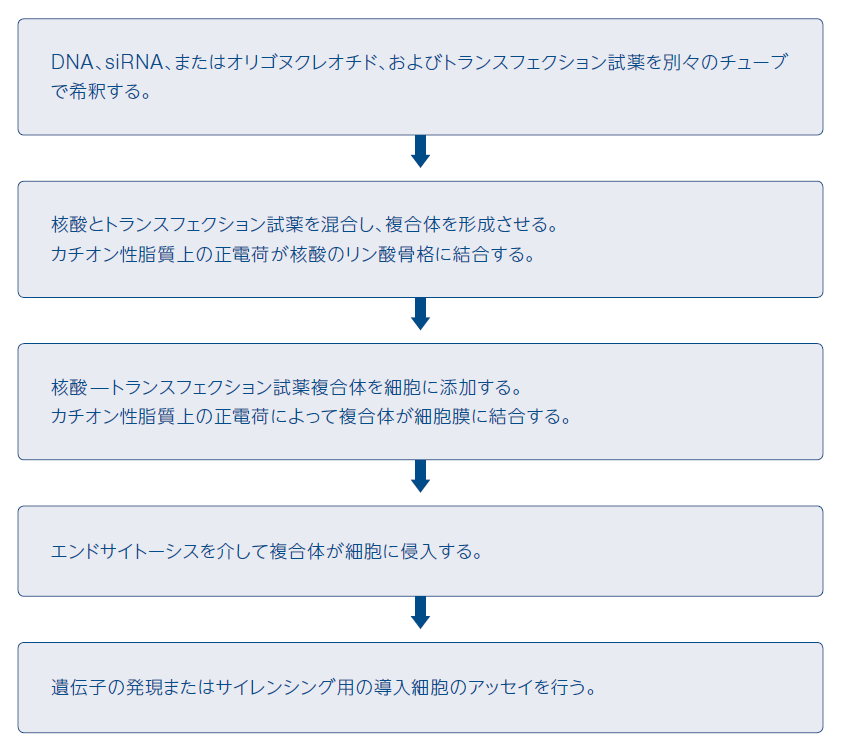
カチオン性脂質媒介性トランスフェクションは、外来遺伝物質を細胞に導入するための最も一般的な手法の1つです。第一世代の脂質ベースのトランスフェクション試薬では、核酸を封入した後、細胞膜を溶解し、そのカーゴを内部に蓄積する人工リポソームが利用されましたが(Fraley et al., 1980)、新しいカチオン性脂質ベースの試薬では、負に荷電した核酸と正に荷電した合成脂質試薬の頭部基との間の静電相互作用によって自発的な縮合が生じ、核酸―カチオン性脂質試薬複合体が形成されます。複合体はエンドサイトーシスを介して細胞に取り込まれ、細胞質に放出されると考えられます。一旦複合体が細胞内に入ると、導入されたDNAは核に移行し、未知のメカニズムによって発現されますが、RNAやアンチセンスオリゴヌクレオチドは移行ステップをスキップし、細胞質内に留まります。
カチオン性脂質媒介性トランスフェクションの利点は、幅広い細胞系の高効率な導入が可能で、ハイスループットスクリーニングに適合し、全サイズのDNAに加えてRNAおよびタンパク質の導入も可能な点です。さらに、この手法は安定および一過性発現の両方に適合し、他の化学的手法とは異なり、DNAおよびRNAの動物およびヒトへのin vivo導入にも使用できます。カチオン性脂質媒介性トランスフェクションの主な欠点は、トランスフェクション効率が細胞タイプと培養条件に依存するため、それぞれの細胞タイプとトランスフェクション試薬についてトランスフェクション条件を最適化する必要がある点です。
弊社は、DNA、RNA、siRNA、またはオリゴヌクレオチドを幅広いタイプの細胞に効率的に導入するためのInvitrogen™ Lipofectamine™ 3000 Transfection Reagentをはじめとするカチオン性脂質媒介性トランスフェクション試薬を提供しています。Lipofectamine 3000試薬は、最も先進の脂質ナノ粒子テクノロジーを利用しており、様々な導入困難な細胞における優れたトランスフェクション効率と再現性の高い結果を実現し、細胞生存率も改善します。
リン酸カルシウム共沈殿法
リン酸カルシウム共沈殿法は、成分が入手しやすく、安価であるため、1970年代初期に導入されて以来(Graham and van der Eb, 1973)、よく用いられているトランスフェクション法です。さらに、この手法はマスターしやすく、多くのタイプの培養細胞に効果的であり、様々な培養細胞タイプの一過性および安定トランスフェクションに使用可能です。しかしながら、リン酸カルシウム共沈殿法は、pH、温度、およびバッファー塩濃度の微小な変化に対する感受性が高いため変動しやすい傾向があり、また多くのタイプの細胞の培養、特に初代細胞の培養において毒性を持つ可能性があります。加えて、全ての動物に対するin vivo核酸導入が適さず、脂質媒介性トランスフェクションなどの他の化学的トランスフェクション法に比べて比較的低いトランスフェクション効率を示します。
リン酸カルシウム共沈殿法の原理は、リン酸緩衝生理食塩水中でDNAを塩化カルシウム溶液と混合すると、リン酸カルシウム-DNA共沈殿物が生じ、この沈殿の懸濁液を培養細胞の上に乗せることでDNAが取り込まれるというものです。リン酸カルシウムは共沈殿物中に濃縮されたDNAの細胞表面への結合を促進し、DNAはエンドサイトーシスにより細胞に侵入します。DNA̶塩化カルシウム溶液をリン酸バッファーに添加している間、バッファーに通気を供給することは、できるだけ微細な沈殿を確実に形成させるために重要です。なぜなら、DNAは凝集すると細胞に付着することも効率良く細胞に侵入することも困難となるからです。
DEAE-デキストラン法による導入
ジエチルアミノエチル(DEAE)― デキストランは、糖質ポリマー(デキストラン)のポリカチオン性誘導体で、核酸の培養哺乳類細胞への導入に用いられた最初の化学試薬の一つです(Vaheri and Pagano, 1965)。カチオン性DEAE デキストラン分子は、負に荷電した核酸骨格に強固に結合します。これにより生じた核酸 DEAE デキストラン複合体は正味の正電荷を持つため、細胞膜に付着し、エンドサイトーシスあるいはDMSOまたはグリセロールによって誘導される浸透圧ショックにより細胞質に侵入します。
DEAE デキストラン法の利点は、比較的シンプルで、再現性が高く、低コストである点です。欠点は、細胞毒性、幅広い細胞タイプにおける低いトランスフェクション効率(典型的には初代細胞で10%以下)、ならびにトランスフェクション処理中に血清含有率の低い培地を使用する必要がある点です。また、この手法の使用は一過性トランスフェクションに限定され、安定細胞系の作製には適しません。
他のカチオン性ポリマーによる導入
遺伝子導入に使用される他のカチオン性ポリマーとして、カチオン性ペプチドおよびその誘導体(例:ポリリジン、ポリオルニチン)、直鎖または分岐鎖の合成ポリマー(例: ポリブレン、ポリエチレンイミン)、多糖ベースの導入分子(例: シクロデキストリン、キトサン)、天然ポリマー(例: ヒストン、コラーゲン)、および 活性型および非活性型デンドリマーが挙げられます。
カチオン性ポリマーは、疎水性部分を含まず、水に完全に溶解する点でカチオン性脂質と異なります。これらはトランスフェクション効率および細胞毒性の程度が著しく異なりますが、カチオン性ポリマーは全て、核酸-ポリマー複合体を形成することによって同様の様式で作用します。複合体は、静電相互作用を介して細胞膜に付着し、エンドサイトーシスを介して細胞に取り込まれます。取り込み効率は、細胞標的リガンドまたは核移行シグナルをポリマーに結合させることによって改善できます。
カチオン性ポリマーでは、複合体の安定性、結果の再現性、およびトランスフェクション効率がDEAEデキストラン法よりも高められますが、細胞毒性や一過性トランスフェクション研究に限定されるという主要な制限は同じく存在します。高分子量のカチオン性ポリマーは、非生分解性で低分子ポリマーよりも細胞毒性が高い傾向があり、ポリマー/核酸の電荷比の増加によって高いトランスフェクション効率を示します。しかしながら、高分子ポリマーの高い毒性は、高分子構造に低分子ポリマーによる生分解性架橋を取り入れることによって減少させることができます。
生物学的遺伝子導入法
ウイルスによる導入
脂質媒介性トランスフェクションが適さないタイプの細胞には、ウイルスベクターがよく用いられます。ウイルス媒介性トランスフェクションは、形質導入としても知られ、導入困難な細胞タイプでのタンパク質過剰発現やノックダウンのための方法として提供され、臨床研究において最も一般的に用いられている手法です(Glover et al., 2005; Pfeifer and Verma, 2001)。アデノウイルス、オンコレトロウイルス、およびレンチウイルスベクターは、哺乳類細胞培養およびin vivoでの遺伝子導入に幅広く用いられています。他のよく知られたウイルス遺伝子導入の例として、バキュロウイルスおよびワクシニアウイルスベースのベクターによるものがあります。
ウイルスは、in vivoトランスフェクション効率が高く、宿主ゲノムに組み込まれることによって遺伝子発現が維持されるため、臨床試験における遺伝子導入のためのシステムとして好まれていますが、この手法には免疫原性および細胞毒性、技術的に困難で時間と労力を要するベクターの製造方法、バイオセーフティーの要件を満たすための高いコスト、低いパッケージング容量(非ウイルス性ベクターが100 kbまでであるのに対し、大部分のウイルスベクターは10 kbまで)、およびウイルスベクター調製物の感染力の変動などの数多くの欠点があります(Glover et al., 2005; Kim and Eberwine, 2010; Vorburger and Hunt, 2002)。
一般的な形質導入プロトコールには、導入遺伝子を運ぶ組換えウイルスの設計、パッケージング細胞系における組換えウイルス粒子の増殖、増殖されたウイルス粒子の精製およびタイトレーション、および次の目的の細胞への感染が含まれます。初代細胞および細胞系における形質導入効率が極めて高い(約90~100%)場合、ウイルス特異的受容体を運ぶ細胞のみがウイルスに感染します。また、ウイルス増幅に用いられるパッケージング細胞系は非ウイルストランスフェクション法によって導入する必要があることを認識しておくことは重要です。
ウイルスベクターの基本特性
ウイルスベクターは、特定のアプリケーションに合わせて作製しますが、通常、いくつかの基本特性は共通しています。
- 安全性: ウイルスベクターは、多くの場合、病原性ウイルスから作製されますが、取り扱う際のリスクを最小化するように改変されます。この改変には、通常、ウイルスの複製に必要不可欠なウイルスゲノムの一部の欠失が含まれ、ウイルスが細胞に効率良く感染して導入されることは可能としますが、欠損しているゲノムの複製に必要不可欠なタンパク質を供給するヘルパーウイルスの非存在下での新しいウイルス粒子の産生は妨げられます。しかしながら、ウイルスベクター使用の安全性については、腫瘍抑制遺伝子の発現を妨げる、あるいは細胞の悪性形質転換を導く癌遺伝子を活性化するウイルスDNAの異所性染色体組み込みを生じさせる挿入変異に対する懸念は引き続き存在します(Glover et al., 2005)。
- 低毒性: ウイルスベクターが感染した細胞の生理機能に与える影響は最小限にする必要があります。これはin vivoでの遺伝子導入を必要とする研究において特に重要です。なぜなら、もしベクターが外来侵入物とみなされると免疫反応が誘導されるからです(Nayak and Herzog, 2009)
- 安定性: 一部のウイルスは遺伝的に不安定で、急速にゲノム再編成が起きる可能性があります。これは、ウイルスベクターを用いて実施した研究の予測性および再現性に弊害をもたらします。このため、不安定なベクターは通常避けられます。
- 細胞タイプの特異性: 大部分のウイルスベクターは、できるだけ幅広い細胞タイプに感染するように設計されています。しかしながら、その逆が好まれる場合があります。ウイルス受容体は、ウイルスが特定の種類の細胞を標的とするように改変できます。この様式で改変されたウイルスをシュードタイプ(偽型)と言います。
- 選択性: ウイルスベクターには、特定の抗生物質に対して耐性を持つような選択マーカー遺伝子を含ませる必要があり、これによってウイルスベクターが導入された細胞を単離できます。
一般的なウイルスベクター
アデノウイルスは、ほぼあらゆる哺乳類の細胞タイプへの一過性形質導入が可能な、幅広い細胞指向性を持つDNAウイルスです。アデノウイルスは、コクサッキー/アデノウイルス受容体(CAR)と結合することにより、ターゲット細胞に侵入します(Bergelson et al.,1997)。CARと結合した後、アデノウイルスはインテグリンを介したエンドサイトーシスを経て内在化し、続いて核に能動輸送されて、そのDNAがエピソームとして発現されます(Hirata and Russell, 2000)。アデノウイルスベクターは多くの細胞タイプにおける一過性導入においてうまく機能しますが、非分裂細胞などの一部の導入困難な細胞系の導入や安定発現にはレンチウイルスベクターが適します。アデノウイルスのパッケージング容量は7~8 kbです。
レトロウイルスは、宿主細胞の染色体に自らのゲノムを安定的に組み込ませるプラス鎖RNAウイルスです。エンベロープを水疱性口内炎ウイルス糖タンパク質(VSV G)などで偽型化すると、幅広い指向性が備わり、基本的にあらゆるタイプの哺乳類細胞に侵入させることが可能となります。しかしながら、大部分のレトロウイルスは、細胞分裂中の核膜の崩壊に伴い細胞に感染するため、その使用は形質導入における細胞の複製の必要性によって制限されます。レトロウイルスの他の欠点として、挿入変異の可能性および潜在的疾患の活性化の可能性が挙げられます。アデノウイルスと同様に、レトロウイルスは約8 kbの外来遺伝子を挿入可能です。
レンチウイルスは、レトロウイルスファミリーのサブグループであるため、宿主細胞ゲノムに組み込んで、安定的な長期遺伝子発現を提供できます(Anson, 2004)。他のレトロウイルスとは大きく異なり、レンチウイルスはより多用途に使用できるツールで、活性化された核輸送経路を用いて、神経細胞や造血細胞などの非分裂最終分化細胞に形質導入できます。
アデノ随伴ウイルスは、幅広いタイプの分裂細胞および非分裂細胞に形質導入できますが、パッケージング細胞において組換えウイルス粒子を産生させるためのアデノウイルスやヘルペスウイルスなどのヘルパーウイルスとの共感染が必要とされます。この手法では、ヘルパーウイルスを含まない高品質のウイルスストックを獲得することに困難が生じます。また、アデノ随伴ウイルスのパッケージング容量はわずか4.9 kbまでと限られています。一方で、アデノ随伴ウイルスは大部分の細胞タイプにおいて低い免疫原性を示し、ヒト染色体の特定の領域に組み込まれるため、挿入変異を回避できます。
タンパク質の過剰発現に使用できる他のウイルスベクターシステムには、バキュロウイルス、ワクシニアウイルス、および単純ヘルペスウイルスをベースとするベクターがあります。バキュロウイルスは、通常昆虫細胞に感染しますが、組換えバキュロウイルスは、広範な哺乳類細胞タイプにおける組換えタンパク質の一過性発現のための遺伝子導入媒介物として機能します。また、バキュロウイルスベクターに優性選択マーカーを含ませることによって、細胞系が安定的に組換え遺伝子を発現するように誘導できます(Condreay et al., 1999)。ワクシニアウイルスをベースとするベクターは、大きいDNAフラグメントの幅広い哺乳類細胞への導入に用いることができます。しかしながら、ワクシニアウイルスが感染した細胞は1~2日以内に死滅するため、このシステムの使用は一過性タンパク質生産に限定されます。単純ヘルペスウイルスは、神経細胞に感染する二本鎖DNAタイプのウイルスです。
| ウイルスシステム | サイズ | DNAインサートサイズ | 最大力価(粒子/mL) | 感染 | 発現 | 欠点 |
|---|---|---|---|---|---|---|
| アデノウイルス | 36 kb (dsDNA) | 8 kb | 1 × 1013 | 分裂細胞および非分裂細胞 | 一過性 | 強力な抗ウイルス免疫反応を誘発 |
| レトロウイルス | 7–11 kb (ssRNA) | 8 kb | 1 × 109 | 分裂細胞 | 安定 | 挿入変異の可能性 |
| レンチウイルス | 8 kb (ssRNA) | 9 kb | 1 × 109 | 分裂細胞および非分裂細胞 | 安定 | 挿入変異の可能性 |
| アデノ随伴ウイルス | 8.5 kb (ssDNA) | 5 kb | 1 × 1011 | 分裂細胞および非分裂細胞 | 安定: 部位特異的な組み込み | 複製にはヘルパーウイルスが必要: 高純度なウイルスストックの産生が困難 |
| バキュロウイルス | 80–180 kb (dsDNA) | 上限は不明 | 1 × 108 | 分裂細胞および非分裂細胞 | 一過性または安定 | 限定された哺乳類宿主範囲 |
| ワクシニアウイルス | 190 kb (dsDNA) | 25 kb | 1 × 109 | 分裂細胞 | 一過性 | 細胞変性効果の可能性 |
| 単純ヘルペスウイルス | 150 kb (dsDNA) | 30–40 kb | 1 × 109 | 分裂細胞および非分裂細胞 | 一過性 | 潜伏感染時には遺伝子が発現しない |
物理的遺伝子導入法
エレクトロポレーション
エレクトロポレーションは、電気パルスを用いて一時的に細胞膜に孔を形成し、その孔を介して、核酸のような物質を細胞内に通過させる物理的トランスフェクション法です。これは、外来核酸を細菌細胞や哺乳類細胞を含む多くのタイプの細胞に導入するための非常に効率的な戦略です。
エレクトロポレーションはシンプルなプロセスに基づきます。宿主細胞および選択された分子を導電性溶液に懸濁し、混合液周囲の電気回路を閉じます。細胞懸濁液に、最適な電圧で、わずか数マイクロ秒からミリ秒継続する電気パルスをかけます。これによって、細胞膜のリン脂質二重膜が破壊され、一時的に孔が形成されます。同時に細胞膜と細胞質の間の電位差が増大し、DNAのような電荷を持つ分子が電気泳動と同様の様式で細胞膜を通過します(Shigekawa and Dower, 1988)。
エレクトロポレーションの主要な利点は、全ての細胞タイプの一過性および安定トランスフェクションに適用可能な点です。また、エレクトロポレーションは簡単で迅速なため、一度最適なエレクトロポレーション条件が決定されると、短時間で数多くの導入が行えます。エレクトロポレーションの主要な欠点は、高電圧パルスによって相当数の細胞死が引き起こされ、細胞膜は部分的にしか修復されないため、化学的トランスフェクション法に比べて多量の細胞が必要とされる点です。弊社のInvitrogen™ Neon™ Transfection Systemのようにピペットチップ型電極を採用した装置では、電気パルスを細胞中に均一に分配し、エレクトロポレーションチャンバー全体を安定なpHに維持することによって高い細胞死亡率が克服されますが、それでも、エレクトロポレーション効率と細胞生存率のバランスを取るためのパルスおよび電界強度パラメータの最適化は必要とされます。
Neon Transfection Systemとは
Invitrogen™ Neon™ Transfection Systemは、弊社が提供するベンチトップ型の次世代エレクトロポレーション装置で、エレクトロポレーションチャンバーとしてのピペットチップ型電極によって、初代および不死化造血細胞を含む哺乳類細胞、幹細胞、ならびに初代細胞への効率的なトランスフェクションを可能とします。エレクトロポレーションチャンバーは、細胞間に均質な電界を生じ、チャンバー全体で安定なpHを維持できるように設計されており、それによってイオンの生成とごくわずかな熱の生成が抑えられ、キュベットを用いる従来のエレクトロポレーションチャンバーに比べて細胞生存率とトランスフェクション効率が増加します。
Neon Transfection Systemは、核酸、タンパク質、およびsiRNAを初代細胞および幹細胞を含むあらゆるタイプの哺乳類細胞に効率良く、高い細胞生存率で導入します。様々な細胞培養フォーマット(60 mm、6 well、48 wellおよび24 well)にて、10 μLまたは100 μLのサンプル容量を用いて、1回の反応で1×104個から5×106個の細胞にトランスフェクションすることが可能です。
Neon Transfection Systemには、初代細胞および幹細胞を含む様々なタイプの哺乳類細胞に対応できる1種類のトランスフェクションキット(Neon™ Kit)が使用されるため、細胞のタイプごとにバッファーキットを選んで購入する必要はありません。また、Neon装置には核酸/siRNAおよび細胞タイプの24ウェル用の最適化条件検討用プロトコールが予めインストールされており、Neon装置のデータベースには最大50種類の細胞のためのプロトコールのプログラミングおよび保存が可能です。最適化されたプロトコールは、こちらから便利にダウンロードすることもでき、多くの一般的に使用される細胞タイプにおけるトランスフェクション効率を最大化できます。
その他の物理的導入法
エレクトロポレーション以外の物理的遺伝子導入法には、遺伝子銃による微粒子の導入、直接マイクロインジェクション、およびレーザー法によるトランスフェクションがあります。これらの物理的手法は使用するツールがそれぞれ異なりますが、これらは全て、化学的手法やウイルス的手法を使用せずに細胞膜を通過させることによる核酸の細胞質または核への直接導入を可能とします。
端的に述べると、遺伝子銃による微粒子の導入は、粒子照射としても知られ、顕微鏡下で核酸をコーティングした重金属粒子(多くの場合、金またはタングステン)を弾道装置(すなわち、”遺伝子銃”)を用いて宿主細胞に高速で噴射する方法です。遺伝子銃による微粒子の導入は、培養液中の分裂細胞および非分裂細胞ならびにin vivoの細胞への一過性トランスフェクションに用いることができ、これは遺伝子ワクチン接種や農業アプリケーションによく使用されています(Klein et al., 1992; Ye et al., 1990; Burkholder et al.,1993)。この手法は信頼性が高く、迅速である一方、高額な設備を必要とし、サンプルに物理的なダメージを与え、細胞死亡率が高いことから多くの細胞が必要とされます。
直接マイクロインジェクションでは、1度に1細胞について、細針を用いて核酸を細胞質または核に送達します。このため、この方法の使用は遺伝子を卵母細胞に導入して、トランスジェニック動物を作製したり、人工染色体を送達するようなex vivoアプリケーションに限定されます(Cappechi, 1980; Cappechi, 1989; Telenius et al., 1999)。直接マイクロインジェクションの導入効率はほぼ100%ですが、かなりの技術的熟練が必要とされ、極めて労働集約的であり、高頻度で細胞死が生じます。このように、この方法は多数の細胞のトランスフェクションが必要とされる研究には適しません。
レーザー法によるトランスフェクションは、フォトトランスフェクション 、レーザーフェクション、あるいはオプトポレーションとしても知られ、レーザーパルスを用いて一時的に細胞膜を透過させる方法です(Shirahata et al., 2001; Schneckenburger et al., 2002)。レーザーにより細胞膜に孔が生じると、培地とサイトゾルの浸透圧差によって核酸や培地中の他の所望の物質(イオン、低分子、タンパク質、半導体ナノ結晶など)の細胞への侵入が促進されます。レーザー法によるトランスフェクションの利点は、高いトランスフェクション効率と細胞のあらゆる位置に孔を形成できる能力です。しかしながら、この方法には高価なレーザー顕微鏡システムと細胞が基質に付着することが必要とされます。
上述の方法に加えて、他の物理的導入法として、動圧、超音波、または磁場を用いて、裸の核酸または核酸―微粒子複合体を宿主細胞に送達する方法があります。
Gibco細胞培養基礎ハンドブック 無料ダウンロード
細胞培養に関する基礎情報を解説したハンドブックをご用意しています(日本語版、約100ページ)。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
ダウンロード
研究用にのみ使用できます。診断目的およびその手続き上での使用はできません。