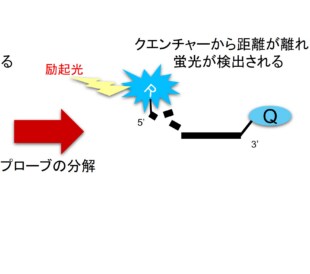
リアルタイムPCRはプライマーデザインが大事です。増幅効率が悪いプライマーを使用してしまうと、正しい定量結果を得られず、誤った結論を導いてしまう可能性があります。また、特異性が低いプライマーセットを使用すると、ターゲット領域でも増幅が起きてしまいます。プライマーダイマーができてしまうプライマーを使用する場合も定量的な結果が得られません。この場合も正しい定量結果が得られません。つまり、信頼性の高いデータが得られるかはプライマーのデザインに左右されるといえます。そこで今回は、正しい定量結果を得るためのプライマーデザインのコツをご紹介いたします。
▼こんな方におすすめです!
・初めてプライマーをデザインする方
・プライマー設計でお悩みの方
▼もくじ [非表示]
ポイント1 増幅効率を高めるには?
反応効率はリアルタイムPCRデータの定量性に重要です。理論上、PCR反応では各ターゲット領域がサイクル毎にコピーされ、1サイクルで2倍にターゲットが増幅します。この1サイクルで2倍に増幅する状態が増幅効率100%の状態です。検量線を引かない相対定量の方法であるΔΔCT法は1サイクルで2倍増幅する、つまりPCR効率が100%と仮定して解析します。そのため、実際のPCR効率が100%から大きく外れてしまうと、発現量の差を誤って算出してしまいます。
反応効率を高めるポイントは「増幅領域は短く」です。たとえば100 bpと1,200 bpを増やす場合を考えます。100 bpの方がきちんと最後まで増幅される(完全合成される)確率が高くなるとイメージできます。1,200 bpの方は途中までしか増幅されていないという確率が高くなります。ですので、リアルタイムPCRのターゲットは完全合成される長さ、一般的に50~150塩基対と短いです。さらに、短い増幅産物はサンプルの分解の影響を受けにくいという利点もあります。つまり、ターゲット配列が長いと、forward およびreverseプライマーが結合する配列が分解の影響で分断されてしまっている可能性が高くなり、このような場合はPCRで増幅させることはできません。増幅領域が短ければ、分解が起きているサンプルであってもforwardとreverseプライマーが同じ断片上にある確率が高くなります。増幅産物が短い方が、多少の分解があってもPCRの増幅に影響は少ないです。
ポイント2 特異性を高めるには?
ターゲット領域以外に同じ配列が存在している場合、ターゲット領域以外でも増幅が起きてしまうため、相同配列、反復配列を排除して設計します。またSNPの個所にプライマーを設計してしまうとSNPのタイプによって増幅のしやすさが変わってきてしまいます。SNPを避けて設計することもポイントになります。
サンプルがRNAという場合にはDNAを検出しない工夫も必要です。どんなに優秀なRNA抽出キットであってもゲノムDNAのコンタミネーションを100%避けることはできません。そのため、DNAを検出しないプライマーを設計する必要があります。
DNAを検出しないためには、プライマーを別のエクソン上にアニールするように設計するか、プライマーの一つをエクソン‐エクソンジャンクション上にデザインすることで、ゲノムDNAを増やさずにRNA由来のターゲットを増やせるようになります。具体的に言いますと、forwardプライマーとreverseプライマーが同一のエクソン内にアニールする場合、DNAもRNA由来のcDNAも全く同じ配列を増幅しますので、共に増幅してしまいます。反対に、プライマーが別のエクソン上にアニールするとcDNAのみが増幅されます。その理由はゲノムDNA由来の増幅産物がイントロン配列を含み、リアルタイムPCRの反応条件で効率的に増幅されるには長すぎるためです。
forwardプライマーとreverseプライマーのTm値を2℃以内にするのも重要なポイントです。Tm値が低いprimerの温度でPCR反応を行うと、Tm値が高いプライマーでは非特異的な配列にアニーリングしてしまう可能性が高まります。
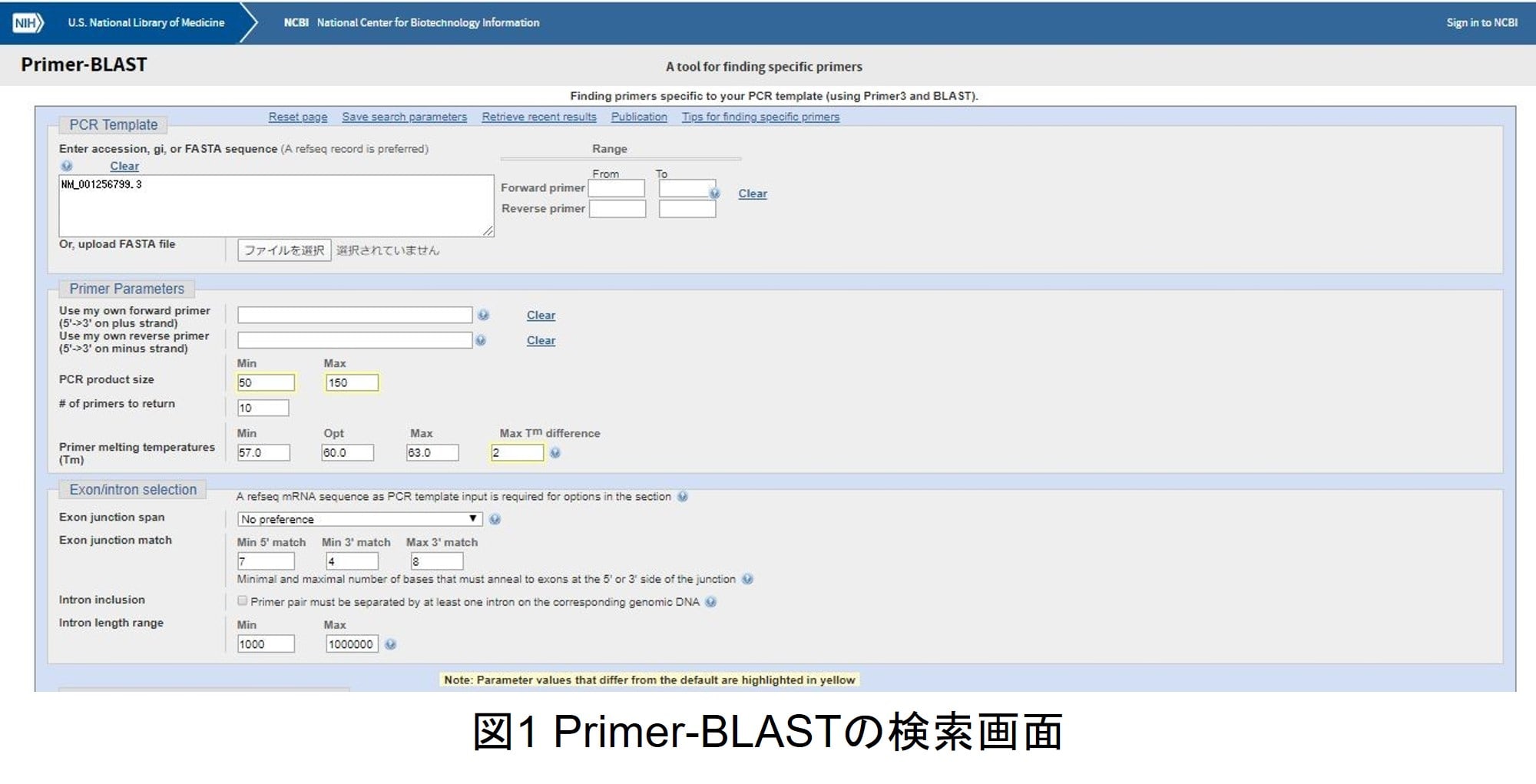
プライマーの設計にはprimer-BLASTが便利です。NCBIデータベースに登録されている配列情報をもとに、ターゲットに特異的なプライマーを設計してくれます。増幅産物の長さやTm値の指定も可能です。
どうしてもDNAも検出してしまうプライマーしか設計できない場合は、DNase処理を行いましょう。
ゲノムDNA由来の増幅が起きているかは、逆転写酵素を含まないコントロール反応系(RTコントロール)を測定することで調べられます。
ポイント3 プライマーダイマーを防ぐには?
プライマーダイマーは、forwardプライマーとreverseプライマーの間の相互作用だけでなく、単一のプライマー同士、または単一のプライマーがヘアピンを形成することによっても起こり得ます。設計時に相補的な配列が存在しないかを確認する必要があります。一般的に、PCR反応の開始時点のターゲットの量が少ないほど、プライマーダイマーが生成される可能性は高くなります。
プライマーダイマーの大きな問題は、偽陽性が得られてしまう点です。特にSYBR™ Green I 色素などのDNA結合色素を使用する反応では問題です。非特異的産物の増幅は、それらが蛍光に影響を与え、結果として反応のCTを擬似的にシフトさせてしまいます。
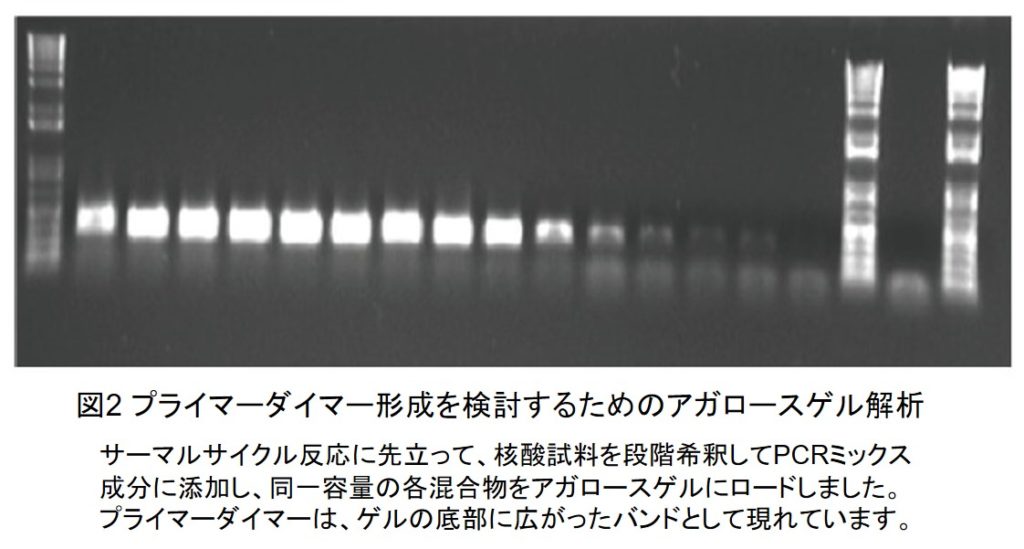
プライマーダイマーが生成されているかを確認する方法として電気泳動があります。プライマーダイマーは、ゲルの底部付近に広がった不鮮明なバンドとしてあらわれます(図3)。ゲル電気泳動を実施すると増幅産物の長さがわかる一方、毎回実施するには手間がかかるというデメリットもあります。
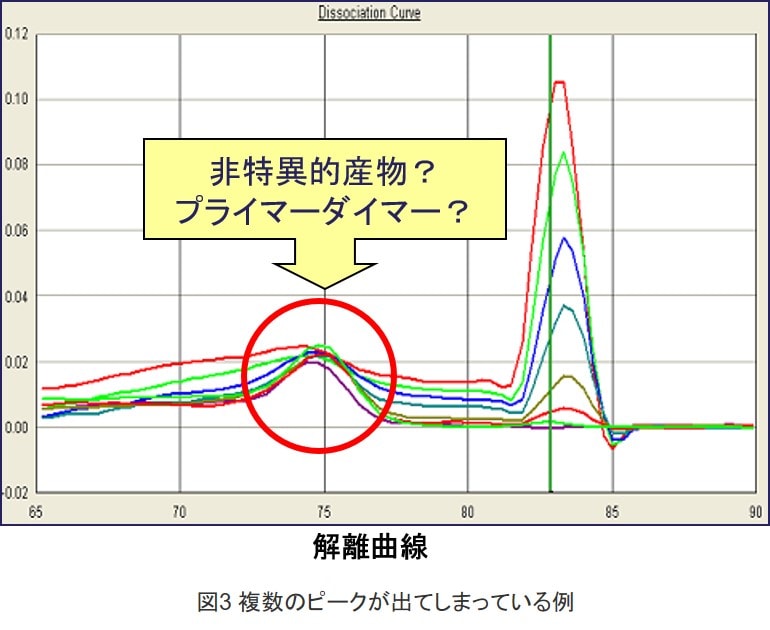
 電気泳動より簡単に、非特異的な増幅が起きていないかを確認する方法として解離曲線があります。PCR反応に続けて融解または熱解離曲線(Melt CurveやDissociationと呼びます)を作成します。DNAが二本鎖で蛍光が高い状態である低温度から、DNAが一本鎖に変性して蛍光が低くなる高温度へと温度を上昇させます。これによりPCR中に生成される各PCR産物のTmにおいて、二本鎖が一本鎖に解離して、SYBR Greenが結合できなくなるため、蛍光の急激な低下が観察されます。テンプレートを含まないコントロール(Non template control:NTC)において得られる融解曲線のピークとターゲットから得られるピークと比較することにより、プライマーダイマーが反応中に存在するかどうかが確認できます。
電気泳動より簡単に、非特異的な増幅が起きていないかを確認する方法として解離曲線があります。PCR反応に続けて融解または熱解離曲線(Melt CurveやDissociationと呼びます)を作成します。DNAが二本鎖で蛍光が高い状態である低温度から、DNAが一本鎖に変性して蛍光が低くなる高温度へと温度を上昇させます。これによりPCR中に生成される各PCR産物のTmにおいて、二本鎖が一本鎖に解離して、SYBR Greenが結合できなくなるため、蛍光の急激な低下が観察されます。テンプレートを含まないコントロール(Non template control:NTC)において得られる融解曲線のピークとターゲットから得られるピークと比較することにより、プライマーダイマーが反応中に存在するかどうかが確認できます。
サンプルを含む各反応に単一なピークが観察され、NTCにおいてピークは観察されないことが望ましいです。期待されるPCR産物よりも低いTm値にあり、NTC反応においても観察されるピークの多くはプライマーダイマーです。
プライマーダイマーが存在していても、リアルタイムPCRアッセイ全体としての精度には影響を与えない場合もあります。プライマーダイマーがNTCには存在し、テンプレートDNAを含む反応には現れないケースも多くあります。テンプレートが存在しなければプライマー同士が相互作用する確率がより高くなることから、この現象は当然のことです。このような場合、プライマーダイマーは問題となりません。
リアルタイムPCRのプライマーを設計される場合には、増幅効率、特異性、プライマーダイマーに注意する必要があります。これらの点に注意して正確な定量を行えるプライマーで実験を行いましょう。
ご自身で設計するのが面倒だな・・・と感じられた方にはApplied Biosystems™ TaqMan™ Gene Expression Assayがお勧めです。PCR効率や特異性を考慮して設計済みのAssayです。ヒト・マウス・ラット・シロイヌナズナ・ショウジョウバエ・線虫・アカゲザルなどの動物種で合計182万種類のAssayがあります。興味がある方は1度ご自身の興味があるターゲットで検索してみてください。
【無料公開中】リアルタイムPCRハンドブック
このハンドブックでは、リアルタイムPCRの理論や実験デザインの設計など、リアルタイムPCRの基礎知識が掲載されています。リアルタイムPCRを始めたばかりの方やこれから実験を考えている方にうってつけのハンドブックです。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
【無料公開中】リアルタイムPCRトラブルシューティング
異常なS字状の増幅曲線、NTCでの増幅検出、増幅が見られないなど、リアルタイムPCRの実験中に困った際の手助けになる情報を紹介しています。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
研究用にのみ使用できます。診断用には使用いただけません。