第10回目の今回は、免疫検出、特定タンパク質の精製、細胞分離といった生化学実験に広く利用されるビオチン結合タンパク質についてご紹介します!
はじめに
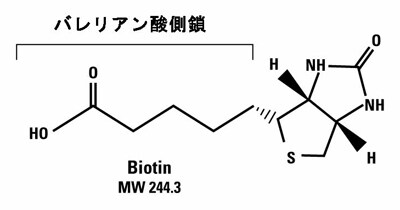
生卵白を過剰に摂取すると健康障害を引き起こすことが知られています。今から70年以上前、この過剰摂取に関する研究の中で、新たなビタミンであるビタミンH (ビタミンB7)としてビオチンが発見されました。続いて、このビオチンとの結合により過剰摂取障害の原因となる卵白中の成分がアビジンであることが発見されました。その後、このビオチンとアビジンとの結合が、非共有結合でありながら非常に強いことが分かりました。さらに、ビオチンのバレリアン酸側鎖(図1参照)には、誘導体化によってさまざまな標識官能基を比較的容易に導入できることから、生体分子へのビオチン標識も可能になりました。ビオチンが低分子(MW 244.3)であるため標識分子への影響も少なく、アビジン-ビオチン間のアフィニティーが高いことから、免疫検出、特定タンパク質の精製、細胞分離といったさまざまな生化学実験に利用されてきました。
以下では、代表的なビオチン結合タンパク質の特性について説明します。
ビオチン結合タンパク質の比較
| アビジン | ストレプトアビジン | ニュートラアビジン | |
| 分子量 | 67 kDa | 53 kDa | 60 kDa |
| ビオチン結合サイトの数 | 4 | 4 | 4 |
| 等電点(pI) | 10 | 6.8 ~ 7.5 | 6.3 |
| 特異性 | 低い | 高い | より高い |
| ビオチンとのアフィニティー(Kd) | 10-15M | 10-15M | 10-15M |
| 非特異的結合 | 高い | 低い | より低い |
アビジン
アビジンは、分子量67,000-68,000 Daの糖タンパク質です。卵白だけでなく、鳥、は虫類、両生類の組織にも存在します。128アミノ酸からなるサブユニットが4量体を形成しており、各サブユニットが1分子のビオチンと結合するため、最大4分子のビオチンと結合できます。このため、アビジンは免疫検出におけるシグナル増幅にも利用されます(ABC法: Avidin-Biotin-Complex法)。アビジンは比較的幅広いpH下でも安定で、等電点(pI)は10-10.5付近にあります。アビジンは、糖鎖が多く(全質量の10%程度)、pIが高いため、非特異的な結合を起こしやすいという欠点があります。
ストレプトアビジン
アビジンのアナログであるストレプトアビジンは、Streptomyces avidiniiから単離される分子量75,000 Daのビオチン結合タンパク質で、等電点は酸性(pI = 5.5)側にあります。組換えタンパク質合成されているStreptavidinの場合、分子量53,000 Daで等電点は中性付近にあります。アビジンと同様、サブユニットが4量体を形成しており、最大4分子のビオチンと結合でき、サブユニット同士のアフィニティーはアビジンより高いことが知られています。ストレプトアビジンは、糖鎖修飾を受けておらず、水への溶解性はアビジンに比べて低くなりますが、アビジンに比べて非特異的な結合が起きにくくなります。ただし、ストレプトアビジンにはRYD(アルギニン-チロシン-アスパラギン酸)配列が含まれているため、細胞を利用する実験系では特に、この配列が原因でバックグラウンドが上昇する場合があります。RGD(アルギニン-グリシン-アスパラギン酸)配列に似ているRYD配列は、細胞接着性タンパク質に含まれる、細胞表面タンパク質と結合する配列です。
ニュートラアビジン
ニュートラアビジン (NeutrAvidin) は、アビジンから糖鎖を除去したビオチン結合タンパク質です。ニュートラアビジンはRYD配列を持たないため、ストレプトアビジンのようにRYD配列が原因でバックグラウンドが上昇することはありません。また、糖鎖除去しているためレクチンとの非特異的結合が抑えられています。ニュートラアビジンの等電点は中性付近にあります。なお、糖鎖除去によってビオチンとの結合アフィニティーは低下しません。
アビジン-ビオチン複合体
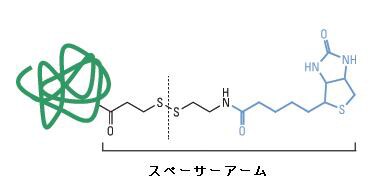
アビジン-ビオチン間のアフィニティーは非常に高く(Ka = 10-15M)、一度複合体を形成すると、pH、温度、有機溶媒や変性剤の影響を受けにくいことが知られています。このアフィニティーの高さはストレプトアビジン-ビオチン複合体でもニュートラアビジン-ビオチン複合体でも同じです。アビジン-ビオチン複合体を確実に解離させる場合は、8Mグアニジン塩酸(pH 1.5)での処理やSDSサンプルバッファー中での煮沸を行います。ただしこの条件では、ビオチン標識タンパク質を非変性状態で回収することが困難です。標的分子の変性を避けて回収する方法としては、スペーサーアーム部分にジスルフィド結合を有するビオチン標識試薬(図2)を利用し、アビジンとの切り離しに還元剤を利用する方法や、モノマー化したアビジンを利用する方法が挙げられます。Pierce Immobilized Monomeric Avidin Agaroseは、アビジンのサブユニットモノマーをアガロース担体に固定化した製品で、ビオチンに対する特異性は保持しながら、ビオチンとのアフィニティーが低い(Ka = 10-8M)ため、ビオチン(2 mM)を含むリン酸緩衝生理食塩水(PBS)を用いた穏やかな条件下で、競合的にビオチン標識タンパク質を回収できます。
最後に
ビオチンとビオチン結合タンパク質の相互作用は、さまざまな生化学実験に使用されています。市販品を含め、目的タンパク質のビオチン標識体が入手できない場合、目的タンパク質に対するビオチン標識技術も重要になります。次回は各種ビオチン標識試薬の特長や注意点について説明します。
【無料ダウンロード】タンパク質解析ワークフローハンドブック
効率的なタンパク質抽出からウェスタンブロッティングの解析ツールまで、包括的にソリューションを紹介しております。PDFファイルのダウンロードをご希望の方は、下記ダウンロードボタンよりお申込みください。
研究用にのみ使用できます。診断目的およびその手続き上での使用はできません。