今回は、ビオチン標識試薬の種類と使用上の注意点についてご紹介します!
▼もくじ [非表示]
はじめに
タンパク質への分子標識では、主に、アミノ基、スルフヒドリル基、カルボキシル基、アルデヒド基(糖鎖の酸化)の4つの官能基を利用する方法が用いられます。また特定の官能基に作用させるのではなく、非特異的に標識させる方法もあります。前回も簡単に触れましたが、ビオチン分子中には誘導体化によってさまざまな官能基を比較的容易に導入することができるバレリアン酸側鎖が存在することから、多くの種類のビオチン標識試薬が合成されており、利用する官能基、標識試薬の親水性、標識反応後の切断の有無、スペーサーアームの長さの違いから、目的に合わせた選択が可能です。
[ss url=”https://www.thermofisher.com/blog/learning-at-the-bench/protein-basic10/” width=”180″ class=”alignleft” alt=”知っておきたい!タンパク質実験あれこれ 第10回” rel=”nofollow” ext=0 title=”知っておきたい!タンパク質実験あれこれ 第10回 10分で分かるビオチン結合タンパク質まとめ” caption=”今回は、免疫検出、特定タンパク質の精製、細胞分離といった生化学実験に広く利用されるビオチン結合タンパク質についてご紹介します!” ]
アミノ基を標的としたビオチン標識試薬
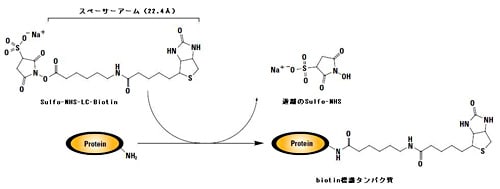
最も広く利用されているのがアミノ基(主に1級アミン: -NH2)を標的とする方法です。アミノ基は多くのタンパク質に含まれているリジン残基の側差やアミノ末端に存在します。特にリジン残基のεアミノ基は反応性が高く、また多くの場合、タンパク質三次構造の表面にリジン残基が存在することから、アミノ基は利用しやすい官能基です。アミノ基反応性のビオチン標識試薬の代表はN-ヒドロキシスクシンイミド(N-Hydroxysuccinimide、略称: NHS)–エステルを持つビオチンです。NHS-エステルはアミノ基と反応してアミド結合を形成します。この反応は、脱プロトン化しているアミノ基の非共有電子対がNHS-エステルに求核的に攻撃することにより起こるため、中性以上の高いpHにおいて起こりやすくなります。しかしながらpHが高いほど、NHS-エステルは水溶液中で加水分解を起こしてしまうため、NHS-エステルとアミノ基との反応は通常pH7-9付近で行います。当然ながら、アミノ基を持つ分子(TrisやGlycineなど)は競合阻害してしまうため標識反応液中から除去しておく必要があります。
NHS-エステル ビオチンには、スルホン酸基を持つ水溶性のスルホ-NHS-エステル ビオチンとスルホン酸基を持たない非水溶性のNHS-エステル ビオチンがあります。スルホ-NHS-エステル ビオチンはチャージを持つため細胞膜を透過しにくく、細胞表面に存在するタンパク質へのビオチン標識に有用です。一方、細胞内のタンパク質標識にはチャージを持たない膜透過性のNHS-エステル ビオチンを使用します。
スルフヒドリル基を標的としたビオチン標識試薬
システイン残基のスルフヒドリル基(-SH)は、アミノ基の次によく利用されます。特にタンパク質の活性部位にアミノ基が存在し、アミノ基を標識することによるタンパク質の失活が問題になる場合にスルフヒドリル基が利用されます。ただし、標識反応を行う際には、スルフヒドリル基は還元状態、つまり酸化によるジスルフィド結合(S-S結合)形成を行っていないことが必要です。還元状態のスルフヒドリル基が存在しない場合は、還元剤によってジスルフィド結合を開裂させる必要があります。当然ながら、スルフヒドリル基を持つ還元剤(DTTや2-メルカプトエタノール)は競合阻害してしまうため標識反応前に除去する必要があります。なお、還元剤の中でもスルフヒドリル基を持たないTCEPを用いた場合には除去する必要がありません。ちなみにペプチドで分子内にシステイン残基を含まない場合は、リジン残基を修飾してスルフヒドリル基を生成させるTraut’s ReagentやSATAを利用することもできます。
スルフヒドリル基反応性のビオチン標識試薬の代表はマレイミド基を持つビオチンです。マレイミドは高いpH下ではアミノ基とも反応性を示すこと、NHS-エステルと同様に加水分解を受けることから、標識反応は中性付近(pH 6.5-7.5)で行います。スルフヒドリル基とマレイミドの反応は、pH 7の条件下ではアミノ基に比べて1,000倍高い反応性を示します。
カルボキシル基を標的としたビオチン標識試薬
カルボキシル基(-COOH)はアスパラギン酸やグルタミン酸の側差の他、カルボキシル末端に存在します。カルボキシル基を標的とする場合、カルボジイミド基を持つクロスリンカーを介してアミノ基(-NH2)を持つビオチンやヒドラジド誘導体化ビオチンを反応させてアミド結合を形成させます。カルボジイミド基を持つクロスリンカーとして、EDC(1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride)がよく利用されます。通常、pH 4.5-5のMES buffer中で反応を行います。当然ながら、アミノ基を持つ分子(TrisやGlycineなど)やカルボキシル基を持つ分子(酢酸やクエン酸など)は競合阻害してしまうため標識反応液中から除去しておく必要があります。また、リン酸バッファーは標識効率を下げることが知られているため、あまりおすすめできません。
この標識方法では、標的ペプチドやタンパク質の末端アミノ基とカルボキシル基が次々とEDCと反応することによって、ポリマー化してしまうことがあります。このポリマー化は、反応液へのEDCの添加量を極力減らしてビオチン標識試薬の量を増やすことで抑えることができます。
アルデヒド基を標的としたビオチン標識試薬
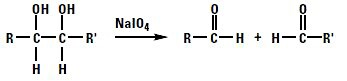
糖鎖上のシアル酸のcis-diolは、過ヨウ素酸ナトリウム(NaIO4)を用いた穏やかな酸化開裂によりアルデヒド基(-CHO)を生成します。アルデヒド基は、pH 4-6においてヒドラジドと反応してヒドラゾン結合を形成します。したがって、糖タンパク質を穏やかに酸化してアルデヒド基を生成させることによりヒドラジド誘導体化ビオチンを標識することができます。アルデヒド基を標的とした方法は、抗体(特に糖鎖修飾が多いポリクローナル抗体)へのビオチン標識に利用されます。この方法では、抗体のFc領域に存在する糖鎖を利用できるため、抗体の抗原認識を阻害せずにビオチン標識することができます。ただし、この方法では糖タンパク質の種類によって、過ヨウ素酸の濃度、反応温度、pHの至適条件が異なるため実験的に条件検討する必要があります。アルデヒド基とヒドラジドとの反応はアミノ基を持つ分子(TrisやGlycineなど)によって阻害されるため反応液から除去しておく必要があります。
光反応性のビオチン標識試薬
標的タンパク質やペプチド上に、利用可能な官能基がない場合、あるいは敢えて非特異的な標識が必要な場合には、アリールアジド基を持つ光反応性のビオチン標識試薬が候補になります。アリールアジド基は紫外光照射により活性化され、アリールニトレン(半減期は10-4秒)は、近傍に存在する二重結合や水素結合の電子密度の高い領域や、アミノ基、スルフヒドリル基と非特異的に反応します。さまざまなバッファーで反応が進みますが、酸性条件下や還元剤の存在下ではアリールアジド基が不活性化してしまいます。弊社のSulfo SBED Biotin Label Transfer Kitは、光反応性のフェニルアジド基とアミノ基反応性のNHS-エステルを両端に持ち、スペーサーアームに還元剤による切断が可能なジスルフィド結合を有するビオチン標識試薬で、ラベルトランスファーを利用したタンパク質相互作用解析に有用な試薬です。
ビオチン標識試薬を利用する際の注意点
アビジンのビオチン結合サイトは、アビジンタンパク質の三次構造表面から約9Å内側に空いたポケット部分に存在することが知られています。したがって、アビジンとビオチンの結合効率を上げるためには、ビオチン分子と標識タンパク質との間に、ある程度の長さを持ったスペーサーアームがあることが望まれます。特に、アビジンとビオチンを結合させた後でビオチンと標識タンパク質との間の結合を切断する必要がある場合、スペーサーアームがある方が、切断効率が高くなる傾向にあります。
ビオチン分子を複数標識することによって、標的タンパク質の可溶性が低下する場合があります。この問題は、親水性ポリマーであるPEG(polyethylene glycol)をスペーサーアームに持つビオチン標識試薬を使用することで改善することがあります。
最後に
弊社では、さまざまなビオチン標識試薬をご用意しています。目的標識試薬の選択には、Biotinylation Reagent Selection Toolが便利です。利用する官能基、標識試薬の親水性、標識反応後の切断の有無、スペーサーアームの長さの違いを考慮して、適当な試薬を絞り込むことができます。
【無料ダウンロード】タンパク質解析ワークフローハンドブック
効率的なタンパク質抽出からウェスタンブロッティングの解析ツールまで、包括的にソリューションを紹介しております。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申込みください。
研究用にのみ使用できます。診断目的およびその手続き上での使用はできません。