はじめに
Protein A, Protein G, Protein Lといった抗体結合タンパク質(Alphabet Proteinsとも言われる)は、抗体と特異的に結合する細菌由来のタンパク質です。主に抗体精製、免疫沈降、免疫検出に利用されています。今回は、これらの抗体結合タンパク質の性質をご紹介します!
Protein A
Protein Aは、Staphylococcus aureus (黄色ブドウ球菌)の細胞壁に存在する46.7 kDaのタンパク質です。Protein Aは免疫グロブリン(特にIgG)のFc領域に特異的に結合します。IgGとのアフィニティー結合サイト(Ka=10-8M)は4箇所あります。Protein Aは4Mウレアや6Mグアニジン塩酸にような変性剤にさらした後でも活性を保持しています。
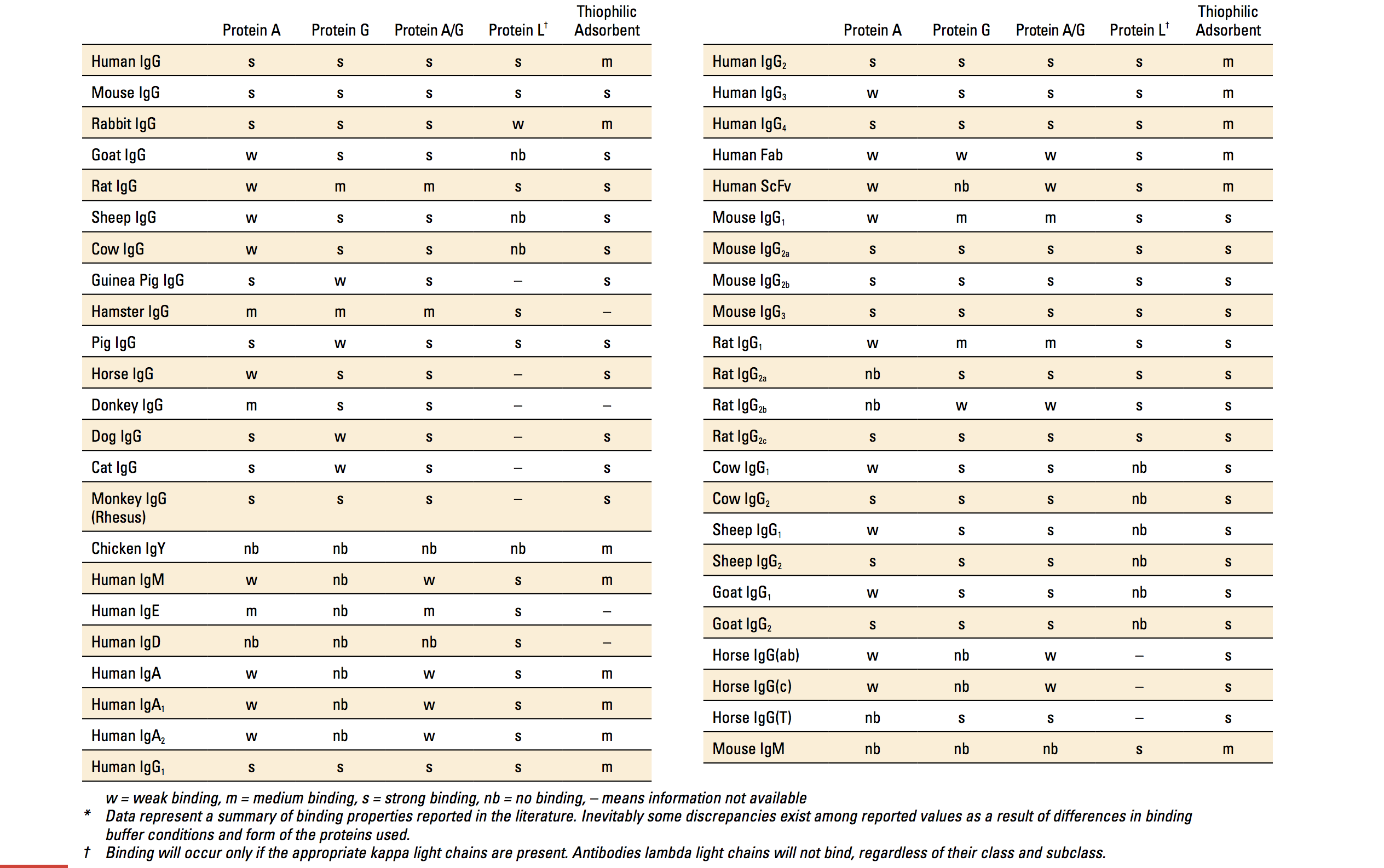
Protein Aと免疫グロブリンとの結合性は抗体の動物種やサブクラスにより異なります(表)。 例えばヒトIgG1, IgG2, IgG4には強く結合しますがヒトIgG3とはほとんど結合しません。またマウスIgG2a, IgG2b, IgG3には強く結合しますがマウスIgG1とのアフィニティーは、生体条件のバッファー(Tris-HClやリン酸ナトリウムバッファー)中では弱くなります(ただし、Pierce™ Protein A IgG Binding Bufferを使用すればマウスIgG1を他のサブクラスに近いアフィニティーで結合させることができます)。抗体精製においては、Protein Aは一般的にウサギのポリクローナル抗体精製によく利用されます。
Pierce™ Recombinant Protein Aは、バシラス属由来のProtein AのうちIgG結合サイト5箇所を残した組換えタンパク質(44.6 kDa)です。
Protein G
Protein Gは、group G streptococci (G群溶血性レンサ球菌)の細胞壁に存在するタンパク質です。Protein Gは免疫グロブリン(特にIgG)のFc領域に特異的に結合し、Fabフラグメントとも弱く結合します。IgGとのアフィニティー結合サイト(Ka=10-8M)は2箇所あり、さらにアルブミンや細胞表面との結合性をしめすサイトもあります。Pierce™ Recombinant Protein Gは、アルブミン結合サイトと細胞表面結合サイトを除去した組換えタンパク質のため、クルードなサンプルからアルブミンを除去してIgG精製できます。Protein Gの分子量は22 kDaですが、SDS電気泳動では34 kDa付近にバンドが検出されます。
Protein Gと免疫グロブリンとの結合性も、抗体の動物種やサブクラスにより異なります(表)。抗体精製においては、Protein Gは一般的に哺乳類のモノクローナル抗体やポリクローナル抗体で、Protein Aとのアフィニティーが低い抗体の精製によく利用されます。ヒトIgG3やラットIgG2aとのアフィニティーが高いのも特長です。Protein Aと異なり、Protein GはヒトIgM, IgD, IgAとはほとんど結合しないことが知られています。一般的に、Protein Gと多くのイムノグロブリンとの結合反応は、中性付近のTrisやリン酸バッファー中で行いますが、実はそのアフィニティーは、pH 5.0の酢酸ナトリウムバッファー下で非常に高くなります。例えば、Tris-HCl pH7.5のバッファー中に比べて酢酸ナトリウム pH5.0のバッファー中ではラット血清中のIgGがProtein Gと44%以上も多く結合します。
Protein L
Protein Lは、Peptostreptococcus magnus 由来の35.8 kDaのタンパク質です。Protein Lは免疫グロブリン(特にIgG)のκ軽鎖と特異的に結合します。Protein AやProtein Gと異なり、重鎖には結合しないため免疫グロブリンの幅広いクラス(IgG, IgM, IgA, IgE, IgD)と結合します(表)。κ軽鎖をもっていれば、一本鎖抗体(scFv)やFabフラグメントとも結合可能です。ただし、κ軽鎖を持っていても、例えばヒトのVκI, VκIII, VκIVを持つ抗体とは結合しますが、VκIIを持つ抗体とは結合しません。またマウスの場合VκIを持つ抗体とのみ結合します。Protein Aと免疫グロブリンとの結合性は抗体の動物種やサブクラスにより異なります例えばヒトIgG1, IgG2, IgG4には強く結合しますがヒトIgG3とはほとんど結合しません。Protein Lは、腹水や細胞培養上清からVκIを持つモノクローナル抗体を精製する際に特に利用されます。
最後に
弊社では、Protein AのFc結合ドメイン4つとProtein Gの同ドメイン2つを遺伝子工学的に融合して組換え合成したProtein A/G (50.5 kDa)もご用意しています。Protein A/GはProtein AとProtein Gの結合特性をあわせ持つため、IgGのサブクラスが不明な場合にも有用です。
【無料ダウンロード】タンパク質解析ワークフローハンドブック
効率的なタンパク質抽出からウェスタンブロッティングの解析ツールまで、包括的にソリューションを紹介しております。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申込みください。
共免疫沈降法関連、その他の記事はこちら
研究用にのみ使用できます。診断用には使用いただけません。