今回のテーマは「界面活性剤の特性と種類」と題して、界面活性剤の概論とタンパク質実験で使用する際に留意すべき点をご紹介します!
界面活性剤の特性と種類
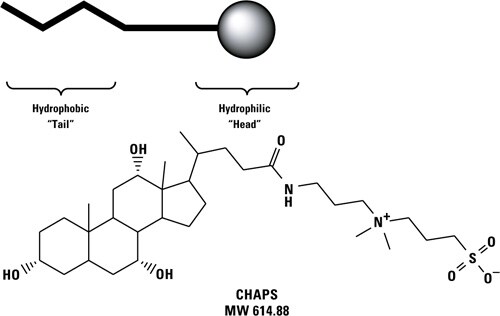
界面活性剤は脂肪族や芳香族からなる非極性部分(テール)と極性部分(ヘッド)の両方を有する両親媒性の分子です(図1)。界面活性剤はヘッドグループの性質によってイオン性(有する電荷によって陽イオン性または陰イオン性がある)、非イオン性(電荷をもたない)、または両イオン性(正負両方の電荷をもつが分子全体の電荷はゼロ)に大きく分類されます。各界面活性剤の性質は、そのヘッドグループとテールグループの特性(親水疎水性のバランス, 鎖長, かさの高さ)によって決まります。界面活性剤は水溶性の分子であり、非極性のテールグループが疎水相互作用に関与することから生体膜を構成するリン脂質に類似した性質を有しており、水に不溶性の疎水性分子を水溶液中に分散(混和)させることができます。
図1 界面活性剤分子のイメージ図(上図)と両イオン性界面活性剤(CHAPS)の構造式(下図)
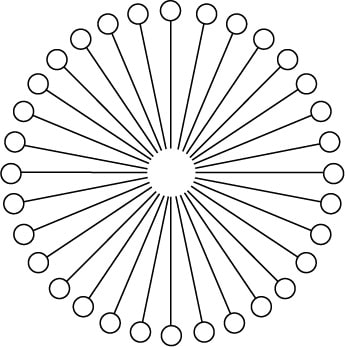
界面活性剤は水溶性の分子ですが、水溶液中での濃度が低いときは通常テールグループ(疎水基)を気相側に向けた状態で、その大部分が気液界面に集まります。水溶液中での濃度が高くなると、熱力学的により安定化するために互いに会合し、外側にヘッドグループ(親水基)、内側にテールグループ(疎水基)をもつミセルを形成します(図2)。界面活性剤がこのミセルを形成する最低濃度を臨界ミセル濃度(Critical Micelle Concentration: CMC)と呼びます。また界面活性剤がミセルを形成するときの温度を臨界ミセル温度(Critical Micelle Temperature: CMT)と呼びます。界面活性剤は(CMT以上の温度で)CMCより濃度が高くなるとミセルを形成した透明な液体となります。CMTより低い温度では不溶性の結晶状態(またはモノマーとの共存状態)で存在します。ただしCMTより高い温度でも曇り点(Cloud Point)と呼ばれる温度を超えると不透明な濁った溶液となり、遠心すると界面活性剤を含む相と水の相とに分離(分配)します。弊社製品のMem-PER™ Plus Membrane Protein Extraction Kitでは、膜タンパク質を抽出するためにTriton X-114のこの分配原理を利用しています。
図2 水溶液中の界面活性剤ミセルのイメージ図
界面活性剤の性質は実験で使用する際の濃度、反応温度、バッファーpH、イオン強度などによって異なります。非イオン性界面活性剤のCMCは温度上昇とともに減少し、イオン性の界面活性剤は対イオン(イオン性界面活性剤と反対の電荷をもつ低分子イオン)を添加するとヘッドグループ間の静電反発力が減少しCMCが減少します。また、ウレアを添加すると水素結合している水分子の構造がくずれてCMCが減少します。一般的にイオン強度が高い溶液中では低い溶液に比べてミセルサイズが大きくなります。
界面活性剤のうちSDS (Sodium Dodecyl Sulfate) のようなアニオン性界面活性剤やCTAB (Cetyl Trimethyl Ammonium Bromide) のようなカチオン性界面活性剤は変性作用をもち、タンパク質・タンパク質間の相互作用を破壊してタンパク質を変性させます。一方、TritonX-100のような非イオン性界面活性剤やCHAPSのような両イオン性界面活性剤、コール酸ナトリウムやデオキシコール酸ナトリウムなどの胆汁酸塩(アニオン性界面活性剤)は非変性的な界面活性剤として知られています。特に非イオン性または両イオン性の界面活性剤は一般的にイオン性の界面活性剤よりもマイルドで、タンパク質の変性が少ないことが知られています。
タンパク質への結合と可溶化
変性作用をもつ界面活性剤であるSDSは、CMC以下の濃度(モノマー状態)で膜タンパク質(疎水性)にも膜タンパク質以外の水溶性タンパク質にも結合します。SDSは分子同士が協調的にタンパク質に結合し、1分子のSDSがタンパク質に結合すると別のSDS分子の結合が促進されます。SDSがタンパク質に十分結合するとタンパク質は変性して高次構造が破壊され、全体としてほぼ均一に負の電荷を帯びた分子となります。その結果、タンパク質は分子量に依存した直鎖上の分子となります。一方、非イオン性界面活性剤であるTriton X-100は、非電荷(非イオン性)のヘッドグループを持っており一般的に水溶性タンパク質の構造や相互作用の破壊には向いておらず、膜タンパク質の疎水領域との結合を利用して膜タンパク質を分離するために利用されます。
界面活性剤のモノマー分子はCMCより低い濃度でも水溶性タンパク質と結合します。界面活性剤の濃度が増加すると、CMCより低い濃度ではタンパク質への結合量が増加します。界面活性剤の濃度がCMCを超えるくらいでは、モノマー分子のタンパク質との結合と、界面活性剤の会合(ミセル形成)とが競合し(1)、CMCを超えて更に界面活性剤の濃度が高い状態では、タンパク質と結合する界面活性剤のモノマー分子の数は増加せず一定になります。したがって、適当な界面活性剤を用いてタンパク質を十分に可溶化するためには、少なくともその界面活性剤のCMCよりも高い濃度をタンパク質溶液に添加する必要があります。しかし、CMCを超える濃度で、なおかつ溶液中に存在するタンパク質とモノマー分子との結合が飽和する濃度以上、過剰に界面活性剤が添加されてもタンパク質と結合するモノマー分子の濃度は変化せず(頭打ちになり)、タンパク質の可溶化にはそれ以上影響を与えません。むしろ界面活性剤を過剰に使用すると、後に除去することが難しくなります。
界面活性剤の除去については後述しますが、一般的な除去法として用いられる透析では、界面活性剤のミセルのサイズが透析膜のポアサイズよりも大きいと除去が困難です。界面活性剤を除去するためにはCMCより低い濃度に希釈して界面活性剤をモノマー化し、透析膜を通過できるサイズにする必要があります。このとき界面活性剤濃度が極端に高いと、希釈率も非常に高くなるだけでなくタンパク質が過剰に希釈されるため現実的ではありません。具体例として、1%程度のNP-40を用いて調製した細胞ライセートからNP-40を除去する場合、NP-40のCMCは0.0179%のため細胞ライセートを少なくとも55倍以上に希釈しなければ効率よく除去することができません。このように界面活性剤を後で除去する場合には、あらかじめCMCの高い界面活性剤を選択することも重要になります。
生体膜に存在する膜タンパク質の可溶化は、界面活性剤のモノマー分子が生体膜の脂質二重層内に分け入ることからはじまります。膜タンパク質の可溶化ステップは、使用する界面活性剤の量によっていくつかのステージに分けることができます(表1)。最初のステージでは界面活性剤が生体膜に入り込みます。界面活性剤と生体膜脂質とのモル比0.1:1~1:1においては、脂質二重層は(セミ)インタクトな状態で存在します(一部の膜タンパク質はこのとき選択的に抽出されます)。モル比が2:1に増加すると生体膜は可溶化されて界面活性剤と混合ミセルを形成します。混合ミセルには、リン脂質と界面活性剤で形成されるミセル、界面活性剤-タンパク質複合体のミセル、脂質-界面活性剤-タンパク質複合体のミセルが存在します。モル比が10:1になると、生体膜脂質-タンパク質間の相互作用はほとんど界面活性剤-タンパク質間の相互作用に置き換わります。
| 界面活性剤:生体膜脂質 (モル比) |
状態 |
| 0.1 : 1 〜 1 : 1 | 界面活性剤が入り込んだセミインタクトな脂質二重層 |
| 2 : 1 | リン脂質-界面活性剤、リン脂質-界面活性剤-タンパク質、タンパク質-界面活性剤 |
| 10 : 1 | リン脂質-界面活性剤、タンパク質-界面活性剤 |
タンパク質抽出に適した界面活性剤の量は、使用する界面活性剤のCMC値や、ミセルあたりの界面活性剤分子の数を表すミセル会合数(aggregation number)、反応温度、膜の性質によって異なります。また、通常ミセル1個あたり1分子のタンパク質が含まれるため、膜タンパク質の可溶化バッファーには膜タンパク質1分子あたりミセル1個分以上の濃度の界面活性剤を添加する必要があります(2)。
可溶化タンパク質からの界面活性剤の除去
界面活性剤は細胞溶解や膜タンパク質の抽出に有効ですが、抽出後のタンパク質を用いる下流のアプリケーションや実験では界面活性剤を除去しなければならない場合があります。例えば、界面活性剤で可溶化された膜タンパク質は脂質との相互作用が破壊されたことにより活性を失うことがありますが、抽出時に使用した界面活性剤をリン脂質や生体膜脂質と類似した脂質混合液で置き換えることによって再び活性をもつことがあります。また、タンパク質の活性が問題にならない場合でも、タンパク質定量やゲル電気泳動に供する際に、抽出時に使用した界面活性剤が適しておらず除去する必要がある場合があります。
透析法はCMCが高い界面活性剤やミセル会合数が小さい界面活性剤の除去に有用です。反対にCMCが低い界面活性剤やミセル会合数が大きい界面活性剤は、ほとんどが透析膜のポアサイズよりも大きいミセル状態で存在しており、共存しているモノマーしか効率的に排除することができません。表2には代表的な界面活性剤のCMCやミセル会合数とともに透析による除去の可能性をまとめました。
イオン交換クロマトグラフィーも界面活性剤の除去に有用です。非イオン性または両イオン性界面活性剤のミセルについて、イオン交換樹脂にタンパク質を含むミセルを吸着させ、タンパク質を含まないミセルを素通りさせることで分離できます(3)。樹脂に吸着したタンパク質はイオン強度やpHの異なるバッファーで溶出するか、または別の界面活性剤に置き換えて溶出します。
その他に、ショ糖密度勾配を利用した方法(4)、アセトン沈殿を利用する方法、ゲル濾過クロマトグラフィーが利用されます。例えば、弊社製品のSDS-Out Precipitation Kitはマイクロスピンチューブを用いて、小容量(380 µl)のサンプルからSDSを除去するためのキットです。
界面活性剤の純度
さまざまな種類の界面活性剤が市販されており、多くの研究室で界面活性剤が利用されています。しかし、界面活性剤の純度や安定性については一般的にあまり重要視されていません。多くの場合、市販の界面活性剤には不純物が含まれています。不純物の中でも特に非イオン性界面活性剤によく含まれている過酸化物はタンパク質を不活性化することがあります(5、6)。また、不純物を含んでいるために空気や紫外光にさらされることですぐに酸化してしまい、可溶化能が低下する界面活性剤もあります。弊社製品の界面活性剤シリーズでは、高純度で過酸化物をほとんど含まない製品をラインナップしています。これらの製品は、窒素ガス充填した透明のガラスアンプルに個別包装した高品質の製品として提供しています。
| 界面活性剤 | 分類 | ミセル会合数 | ミセル分子量 (Da) | 分子量 (Da) | CMC (mM) | CMC (% w/v) | 曇り点 (℃) | 透析による除去* |
| Triton X-100 | 非イオン性 | 140 | 90,000 | 647 | 0.24 | 0.0155 | 64 | 困難 |
| Triton X-114 | 非イオン性 | – | – | 537 | 0.21 | 0.0113 | 23 | 困難 |
| NP-40 | 非イオン性 | 149 | 90,000 | 617 | 0.29 | 0.0179 | 80 | 困難 |
| Brij-35 | 非イオン性 | 40 | 49,000 | 1225 | 0.09 | 0.1103 | >100 | 困難 |
| Brij-58 | 非イオン性 | 70 | 82,000 | 1120 | 0.077 | 0.0086 | >100 | 困難 |
| Tween-20 | 非イオン性 | – | – | 1228 | 0.06 | 0.0074 | 95 | 困難 |
| Tween-80 | 非イオン性 | 60 | 76,000 | 1310 | 0.012 | 0.0016 | – | 困難 |
| Octyl Glucoside | 非イオン性 | 27 | 8,000 | 292 | 23 ~ 25 | 0.6716 ~ 0.7300 | >100 | 容易 |
| Octylthio Glucoside | 非イオン性 | – | – | 308 | 9 | 0.2772 | >100 | 容易 |
| SDS | 陰イオン性 | 62 | 18,000 | 288 | 6 ~ 8 | 0.1728 ~ 2304 | >100 | 容易 |
| CHAPS | 両イオン性 | 10 | 6,149 | 615 | 8 ~ 10 | 0.4920 ~ 0.6150 | >100 | 容易 |
| CHAPSO | 両イオン性 | 11 | 6,940 | 631 | 8 ~ 10 | 0.5048 | 90 | 容易 |
* 透析による除去が困難としている界面活性剤でも、CMCより低い濃度に希釈してモノマー化することで除去可能です。また界面活性剤は溶液中でミセルとモノマーが平衡状態で存在しているためモノマーを除去しながら平衡をモノマー側にシフトさせるために長時間透析を行うことで界面活性剤が除去できる場合があります。
最後に
界面活性剤は、バイオ実験においてタンパク質の可溶化や変性のほか細胞からのタンパク質抽出などに幅広く利用されています。実験の目的や下流のアプリケーションに合わせて界面活性剤を選択するためにはそれぞれの特性を理解する必要があります。ここでは界面活性剤の一般的な性質を中心にご紹介しましたが、イオン性や臨界ミセル濃度(CMC)について理解しておくだけでも使用する界面活性剤の選択に役立つことでしょう!
参考文献
1. Helenius, A. and Simons, K. (1975). Biochim. Biophys. Acta 415, 29-79.
2. Helenius, A., et al. (1979). Methods Enzymol. 56, 734-749.
3. Hjelmeland, L.M. (1990). Methods Enzymol. 182, 277-282.
4. Warren, G.B., et al. (1974). Proc. Nat. Acad. Sci. USA 71, 622-626.
5. Chang, H.W. and Bock, E. (1980). Anal. Biochem. 104, 112-117.
6. Ashani, Y. and Catravas, G. (1980). Anal. Biochem. 109, 55-62.
【無料ダウンロード】タンパク質解析ワークフローハンドブック
効率的なタンパク質抽出からウェスタンブロッティングの解析ツールまで、包括的にソリューションを紹介しております。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申込みください。
研究用にのみ使用できます。診断用には使用いただけません。