はじめに
(共)免疫沈降法はタンパク質精製やタンパク質タンパク質相互作用解析を行う古典的な手法ですが、現在でも幅広く利用されている重要な技術です。免疫沈降法は「免疫」と言われる通り、抗原と抗体の特異的な反応を利用しています。単純な手法ですが、見過ごすことのできない重要なポイントがいくつかあります。今回は、基本的な流れのおさらいと、(共)免疫沈降を行う上で関係するファクターについて説明します。
(共)免疫沈降実験の流れ
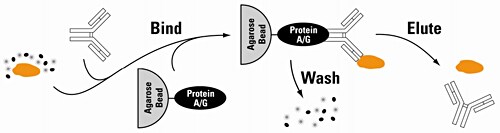
免疫沈降法(Immunoprecipitation, IP)ではまず適当な抗体を用意します。免疫沈降においては精製したい標的抗原に対する抗体、共免疫沈降(Co- Immunoprecipitation, Co-IP)においては標的タンパク質と相互作用することが予想されるタンパク質に対する抗体を用意します。一般的には非変性状態の抗原の捕捉に適した抗体を選択します。市販抗体の中には免疫沈降実験で実績があることを記載している場合もあります。
次に選択した抗体を適当な担体(アガロースレジンなど)に固定化します。IP抗体を固定化した担体を、目的タンパク質を含むサンプルと混合すると、抗原が担体に捕捉されます。抗原が別のタンパク質と相互作用しているときはその複合体が捕捉されます。担体を回収して洗浄すると、目的抗原またはタンパク質複合体を、他のタンパク質などの分子と分離できます。さらに適当な溶出バッファーで処理すると目的抗原や相互作用タンパク質を回収できます。
回収したタンパク質はウェスタンブロッティングやELISAで解析できます。またCo-IPで回収した相互作用タンパク質を質量分析で同定することも可能です。なお、Co-IPにおいて、抗体と反応する既知の抗原タンパク質をbait、baitと相互作用するタンパク質をpreyと呼びます。ちなみにbaitタンパク質を直接(抗体を介さずに)適当な担体に固定化して、preyタンパク質を回収する場合、Pull-downと呼びます。
(共)免疫沈降に関係するファクター
(共)免疫沈降法は比較的シンプルな手法ですが、それでも表に示すような複数のファクターが関係しています。実験を成功させるためにも各ファクターについて理解し、目的に合わせた調製や選択を行うことが望まれます。以下では、それぞれのファクターについて個別に説明します(今回は『実験フォーマット』〜『ライセートの前処理』について説明します)。
| ファクター | 関連する内容 |
| 実験フォーマット | カラム法(スピンカラム、オープンカラム)、バッチ法 |
| 担体の種類 | アガロース担体、アクリルアミド担体、磁性担体 |
| 反応手順 | 抗原抗体反応、抗体の担体への結合 |
| ライセートの前処理 | 非特異結合 |
| 抗体の固定化 | 固定化方法、向き、量 |
| 結合バッファー | 抗原抗体反応条件、タンパク質複合体形成条件 |
| 洗浄バッファー | 界面活性剤、塩、還元剤 |
| 溶出バッファー | pH、塩、変性剤 |
実験フォーマット
カラム法とバッチ法
IP用担体を充填したカラム中で転倒混和しながら反応、洗浄、溶出を行うカラム法では、重力または遠心力を利用して溶液除去や回収を簡便に行うことができます。バッチ法では、チューブ中で転倒混和しながら反応、洗浄、溶出を行います。各ステップでは遠心操作によりIP用担体を沈殿回収します。バッチ法では遠心後の上清除去または回収に手間が掛かるため、カラム法が主流です。
スピンカラムとオープンカラム
カラム法には、遠心力を利用するスピンカラム法と重力を利用するオープンカラム法があります。処理スケールが大きい場合は、適当なコレクションチューブがなく、遠心処理が困難になるため重力を利用するオープンカラムを利用することになります。逆に処理スケールが小さい(数十µL以下になる)場合は、重力での分離処理が困難になるため遠心力を利用するスピンカラムを利用することになります。
処理スケールが大きくなければ、一般的には次の理由からスピンカラムがよく利用されます。オープンカラムでは担体の乾燥やカラムへの空気混入を避けるように注意する必要があるだけではなく、抗原またはタンパク質複合体の溶出の際、複数のフラクションに渡って回収するため溶液量が多くなり、目的タンパク質の濃度が低くなってしまいます。一方、スピンカラムではIP用担体と溶液との分離をより確実に簡便に行えます。
担体の種類
アガロース担体
最も一般的に利用される担体が架橋化アガロースです。架橋化アガロースはリガンドの固定化が比較的容易なだけでなく、通常5,000 x g程度の遠心に耐え、ある程度の耐圧性(~100 psi程度。架橋度により異なる。)があるため使いやすく、また生体サンプルとの非特異結合が比較的少なく、一般的な生化学実験で使用される成分(塩、界面活性剤、有機溶媒)にも適合し、幅広いpH(pH3-14)で使用できます。
ポリアクリルアミド担体
アガロースに代わる担体として架橋化アクリルアミド/ビスアクリルアミドがあります。例えば弊社ではUltraLink担体をご用意しています。UltraLink担体では、1,000 psiまでの耐圧性があるためFPLCでの使用に適しています。ただし、アガロース担体に比べて流速が遅くなるためスピンカラムやオープンカラムでの使用には向いていません。
磁性担体
磁性担体では、カラム操作や遠心操作を行わずに溶液除去や目的タンパク質の回収が行えるため近年よく利用されるようになっています。
反応手順
抗体と結合するタンパク質(例えばProtein A/G)を固定化したIP用担体を利用する場合、次の3種類の手順で(共)免疫沈降を行うことができます。
抗原抗体複合体形成後にIP用担体と結合させる方法
目的抗原を含むサンプルに、IP抗体を反応させて抗原抗体複合体を形成させた後、この複合体をIP用担体に捕捉させる方法です。この方法は一般的に目的抗原の回収量が高い方法とされています。ただし、溶出時には目的抗原(またはbait-preyタンパク質複合体)とともにIP抗体も回収されてしまいます。
IP抗体固定化担体調製後に抗原と反応させる方法
抗体をIP用担体に固定化してから、目的抗原を含むサンプルを反応させる方法です。この方法では上記の方法に比べて目的抗原(またはbait-preyタンパク質複合体)の回収量が落ちる傾向にありますが、次回に紹介する架橋剤を利用する方法により抗体の共溶出を抑えることが可能になります。
IP抗体とIP用担体と抗原サンプルを同時に反応させる方法
この方法は時間の短縮になるものの、目的抗原(またはbait-preyタンパク質複合体)の回収量が落ちる傾向にあります。
ライセートの前処理
比較的非特異結合の低いアガロースやアクリルアミドベースのIP用担体を使用していても、サンプル中のタンパク質が非特異的に担体に結合することがあり、溶出時に目的抗原とともに回収されてしまうことがあります。非特異タンパク質の回収を抑えるためには一般的にプレクリアリングが有効です。プレクリアリングとは、目的抗原を含むサンプル溶液を、IP抗体の結合していない担体とインキュベーションしてから担体を除去する方法で、担体に非特異結合するタンパク質を予め除去できる方法です。
いかがでしたでしょうか?
次回は、各種、抗体の固定化方法に関する情報やバッファー成分の及ぼす影響についてご紹介します。
【無料ダウンロード】タンパク質解析ワークフローハンドブック
効率的なタンパク質抽出からウェスタンブロッティングの解析ツールまで、包括的にソリューションを紹介しております。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申込みください。
研究用にのみ使用できます。診断目的およびその手続き上での使用はできません。