今回は、「夾雑成分の除去」をテーマとして、弊社の透析, ゲルろ過, 限外ろ過の製品の原理や特長について解説します。
はじめに
組織, 細胞や体液からサンプルを調製する場合、変性剤, 界面活性剤や塩などが用いられます。これらの添加物は、続いて行われる下流の実験において、反応阻害因子となることがあります。また、クルードの未精製サンプルには、さまざまな夾雑物質も含まれるため、あらかじめ除去しておくことで、下流の実験での感度や収率が向上する場合もあります。
透析法
透析は、サンプル溶液と透析液を、透析膜(半透膜)を介して接触させることにより、サンプル溶液内の小さな分子と大きな分子を分離する方法です。タンパク質サンプル溶液に、実験に不都合な塩(Tris、PBS など)、還元剤(DTT、β-mercaptoethanol など)、保存薬(アジ化ナトリウム、チメロサールなど)が含まれている場合には除去する必要があります。
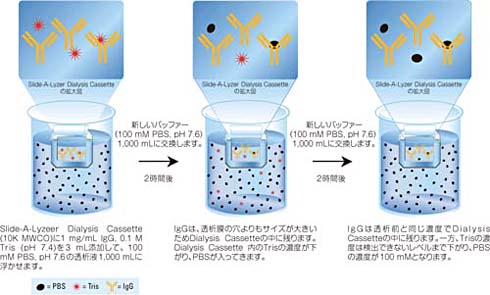
サンプル溶液を透析膜の内側に入れ、サンプル溶液の200~300倍容量の透析液を透析膜の外側にセットすると、透析膜の内側と外側で濃度勾配ができ、溶液中の分子は膜をはさんだ両側の濃度が平衡になるように膜を通過して自然に拡散します。分子は平衡状態に近づくにつれて透析速度が遅くなるため、数時間毎に新しい透析液に交換して再度濃度勾配をつくることで、透析時間を早めることができます。
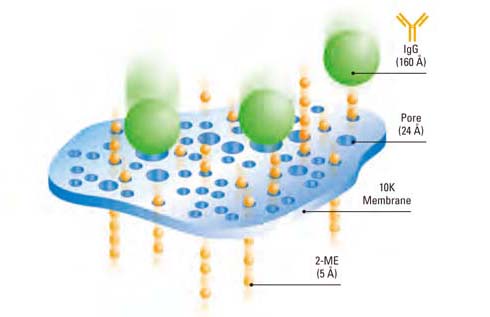
透析膜には小さな穴があいており、穴のサイズによって膜を通過できる分子が制限されます。穴よりも小さい分子は膜を通過し、大きい分子(たとえば、タンパク質や核酸)は通過できません。理想的な透析膜は、厚さが薄く多数の小さな穴があり、その穴の径が均一であるものです。また、タンパク質が非特異的に吸着しないことも重要です。再生セルロースは親水性でバッファーが浸透しやすくタンパク質の吸着が少ないため広く利用されています。さらに、再生セルロース膜は一般的な生化学実験で使用されるpH 範囲や塩濃度で使用でき一部の有機溶媒でも使用できます。
サンプル溶液と透析液の液量も重要です。できるだけサンプル溶液量が少なく透析液量が多いことが、濃度差を最大にできる理想的な実験条件です。透析後の実験で使用するサンプルは少量であることが多く、そのため透析を行う際のサンプル量は重要になります。必要最少量の透析サンプルを用意できたら、それ以上は量を増やさないことをおすすめします。サンプルと透析液が接する表面積にもよりますが、サンプルが少量であるほど透析は早く終了します。サンプルが多いほど時間がかかり、それによってサンプルは長く固相表面に接触して非特異的に結合しやすくなり、サンプルが変性する場合があります。
Thermo Scientific™ Slide-A-Lyzer™ シリーズは、サンプルのローディングや回収が簡単にできるようデザインされた透析カセットです。従来の透析チューブのように両端をクランプで留めたり空気を入れたりする必要はなく、透析カセットにサンプルを入れてキャップをし、外液に浸すだけ。10 μLのミニサイズから、250mlのフラスコサイズまで、容量に応じて選べます。Slide-A-Lyzer G3カセットの動画はこちら。
透析法のメリット
- サンプルはほとんど希釈されない
- 急激なバッファー変化がないためダメージを受けやすいサンプルに有用
- 特別な装置は必要なく操作が簡便
透析法のデメリット
- 時間がかかる
- 使用するバッファー液量が多い
図1 Slide-A-Lyzer Dialysis Cassette を用いた透析の模式図
図2 半透膜による微粒子の拡散状況。透析はサンプル溶液中の低分子化合物と生体高分子を分離する技術で、1950 年頃から生命科学関連の研究分野で広く利用されてきました。当時の論文では、透析がさまざまな物質を含む混合液から生体高分子を分離できる最先端技術として報告されています。弊社の透析製品シリーズでは、当時の透析理論をベースにして、(1)実験のセットアップにかける時間を最小限にしてすぐに使用できること、(2)サンプルが漏れずに確実に回収できること、を追求した製品を開発しています。
ゲルろ過法
ゲルろ過は分子サイズの違いによってサンプルを分離するクロマトグラフィー手法です。ゲルろ過担体は微小な穴の開いた多孔質の荷電をもたない分子で、通常カラムに充填して使用します。担体の穴の大きさによって分離されるサンプルの分子量は変わりますが、一般的にタンパク質や高分子のサンプルから低分子の物質を除きたい時に用いる手法です。ゲルろ過では高分子のサンプルは担体の穴から中に入ることができず、担体の外側を伝ってカラムの下側へ流れていきます。一方、低分子の物質は担体の穴の中に入って長い間とどまるため、高分子のサンプルと低分子物質ではカラムの中を移動する距離が異なり、移動距離の短い高分子のサンプルが先に流出します。
脱塩およびバッファー交換は、ゲルろ過において最もよく使われる方法です。脱塩およびバッファー交換のいずれにおいても、高分子サンプルはカラム平衡化バッファーと同じバッファーに交換されて溶出されます。平衡化バッファーとして水を使えば脱塩になり、別のバッファーを使えばバッファー交換となります。
ゲルろ過を利用した脱塩スピンカラムとして、Thermo Scientific™ Zeba™ spinシリーズがあります。分子量カットオフサイズは7 kDaと40 kDaの2種類です。またカラム容量も5種類あり、サンプル2 μLの少量から4 mLまで対応しています。例えばNaClの除去であれば99%以上もの高い除去率・回収率が得られるため、大きなロスの心配がありません。スピンカラムであれば希釈は最小限に抑えられ、使い方も手軽で簡単。動画から使用方法の流れがご覧いただけます。
ゲルろ過法のメリット
- スピーディー
- 少量のサンプルでもバッファー交換可能
ゲルろ過法のデメリット
- 大量のサンプル処理には不向き
- サンプルが希釈されることがある
- 急激なバッファー変化によってサンプルがダメージを受ける可能性がある
限外ろ過法
限外ろ過法は、半透膜を用いて高分子サンプルと低分子物質を分離する方法です。濃度差を利用した受動拡散の透析法と異なり、圧力をかけるか遠心操作によって強制的に低分子溶液の膜通過を行います。水(溶媒)や低分子物質は膜を通過し、高分子サンプルは膜上で濃縮されます。
Thermo Scientific™ Pierce™コンセントレーターは、PES膜を用いた限外ろ過スピンカップです。使い捨てで、4サイズ(0.5 mL、6 mL、20 mLおよび100 mL)および5種類の分子量カットオフ(3K、5K、10K、30K、100K)が選べます。また、液が必ず残るデッドストップ構造があるため、濃縮液の乾燥を防ぐことができる設計です。
動画で各サイズの使用の流れがご覧いただけます(0.5 mL、6 mL、20 mLおよび100 mL)。
限外ろ過法のメリット
- スピーディー
- 低分子除去と同時にサンプル濃縮が可能
- 比較的大量のサンプル処理も可能
限外ろ過法のデメリット
- 非特異的な吸着が起こることがある
沈殿法
沈殿法はタンパク質を沈殿させて不溶成分を含む上清を除去したあと、下流の実験に適したバッファーでタンパク質を再溶解する方法です。沈殿法では一般的にアセトンやトリクロロ酢酸の他、硫酸アンモニウム(硫安)がよく使用されます。透析法やゲルろ過法では除去できない分子(ある種の界面活性剤や脂質など)の除去に適しています。特にできるだけ不溶成分を除去したい質量分析の前処理においては、透析法やゲルろ過法ではタンパク質吸着によるサンプルロスが危惧される一方で、沈殿法によるタンパク質変性はあまり問題にならないことから、沈澱法が広く利用されています。
沈殿法のメリット
- 低分子以外の物質も除去可能
- 低分子除去と同時にサンプル濃縮が可能
沈殿法のデメリット
- タンパク質の変性が起こりうる
- タンパク質の再溶解が困難な場合がある
まとめ
透析、ゲルろ過、限外ろ過のメリットやデメリットを表にまとめました。ご自身のサンプルや目的に適した方法を選びましょう。
| 手法 | メリット | デメリット | 製品 |
| 透析 | サンプルはほとんど希釈されない 急激なバッファー変化がないためダメージを受けやすいサンプルに有用 特別な装置は必要なく操作が簡便 |
時間がかかる 使用するバッファー液量が多い |
Slide-A-LyzerTMシリーズ |
| ゲルろ過 | スピーディー 少量のサンプルでもバッファー交換可能 |
大量のサンプル処理には不向き 重力フロー法だとサンプルが希釈されることがある 急激なバッファー変化によってサンプルがダメージを受ける可能性がある |
ZebaTM脱塩シリーズ |
| 限外ろ過 | スピーディー 低分子除去と同時にサンプル濃縮が可能 比較的大量のサンプル処理も可能 |
非特異的な吸着が起こることがある | PierceTMコンセントレーター |
| 沈殿法 | 低分子以外の物質も除去可能 低分子除去と同時にサンプル濃縮が可能 |
タンパク質の変性が起こりうる タンパク質の再溶解が困難な場合がある |
– |
ほかにも特定の夾雑物成分除去に特化した製品をラインナップしています。溶液中で会合体を形成してサイズ排除が困難な界面活性剤除去用スピンカラムThermo Scientific™ Detergent Removal Spin Colums &Colums & Plates、血清中の高含量タンパク質を除去するAlbumin Depletion KitやAlbumin/IgG Removal Kits、SDS-PAGE電気泳動サンプルからの阻害物質除去とサンプル濃縮を行うPierce™ SDS-PAGE Sample Prep Kitなど、さまざまな製品をご用意しています。
このブログを見た人はこんなブログも見ています
BCA法、Bradford法、Lowry法など、“総”タンパク質定量法の原理まとめ|知っておきたい!タンパク質実験あれこれ 第4回
硫安、アセトン、TCAなど、タンパク質の沈殿法プロトコールまとめ
【無料ダウンロード】タンパク質解析ワークフローハンドブック
効率的なタンパク質抽出からウェスタンブロッティングの解析ツールまで、包括的にソリューションを紹介しております。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申込みください。
研究用にのみ使用できます。診断用には使用いただけません。