▼もくじ [非表示]
ターゲットアンプリコンのサイズ、GC含量、位置および特異性
反応効率はリアルタイムPCRデータの精度にとって最も重要です。理論上は、PCR反応中は各ターゲットがサイクル毎にコピーされ、ターゲットの全長分子が各サイクルで2倍に増幅します。この状態が100%の増幅効率に相当します。サーマルサイクルが進むにつれて、反応効率の変動は大きくなります。このため、100%の増幅効率から外れることは、誤ったデータにつながる可能性があります。
反応効率の変動を最小限に抑える一つの方法としては、比較的短いターゲットを増幅することです。100塩基対の領域の増幅は、例えば1,200塩基対のターゲットの増幅よりも、1サイクルにおける完全合成の確率が高くなると考えられます。このため、リアルタイムPCRのターゲットの長さは一般的に50~150塩基対となっています。さらに、短いアンプリコンはターゲットテンプレートの長さの変動の影響をあまり受けません。核酸サンプルが若干分解しており、しかもターゲット配列が長い場合には、上流および下流プライマーは同一のDNAフラグメント中に相補的配列を見つける確率が低くなります。
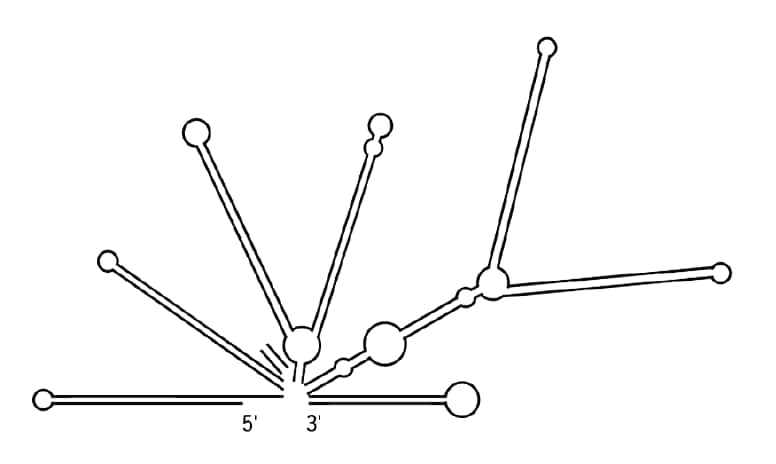
アンプリコンのGC含量および二次構造は、不正確なデータにつながるもう一つの原因となり得ます。DNAポリメラーゼの反応が二次構造により阻害される場合、各サイクルにおけるターゲットの増幅が不完全になりやすくなります。理想的には、プライマーは極端なGCを含まない、中程度(50%)のGC含量の領域にアニールして増幅するようにデザインすることが必要です。cDNAを増幅するためには、アンプリコンを転写産物の3′末端付近に設計することが望ましいです。これらを配慮したアンプリコンは、RNAの二次構造により転写産物からの全長cDNAの合成が阻害される場合においても、その影響を受ける可能性を低くおさえられます(図1)。
ターゲットの特異性はデータの精度に影響するもう一つの重要な因子です。リアルタイムPCRのプライマーをデザインする場合には、プライマーの結合部位がゲノム上の特異的な場所に設計されていることを確認してください。そうすることによって、プライマーにより試料ゲノム中の相同性の高い他の部位の配列が増幅される可能性を抑えられます。プライマーデザイン用のソフトウェアプログラムはもととなるゲノムに対するターゲット配列のスクリーニング過程を自動化し、相同領域をマスクすることによってこれらの位置にプライマーがデザインされないようにします。
ゲノムDNA、偽遺伝子およびアレル変異
RNA試料中へのDNAキャリーオーバーは、発現量の測定において問題となる可能性があります。ゲノムDNAが目的のターゲット転写物とともに増幅されてデータが無効となる可能性があります。ゲノムDNAのコンタミは、逆転写酵素を含まないコントロール反応系(RTコントロール)を設定することにより検出できます。RTコントロール由来のCtが、最も希釈されたターゲットから得られるCtよりも高い場合には、ゲノムDNAは増幅反応に影響していないことが示されます。しかし、ゲノムDNAはdNTPやプライマーなどの反応成分と競合するため、反応効率を低下させる可能性があります。
リアルタイムPCRにおいてゲノムDNAコンタミによる影響を避けるための最良の方法は、ゲノムDNAに存在しmRNAには存在しないイントロンを利用する、周到に考慮されたプライマー(またはプライマー・プローブ)をデザインすることです。Applied Biosystems™ TaqMan™ Gene Expression Assayは可能な限り、TaqManプローブをエクソン‐エクソンジャンクション上にデザインしています。SYBR™ Green 色素ベースの検出用プライマーセットに関しては、隣接するエクソン上にアニールするか、プライマーの一つをエクソン‐エクソンジャンクションに上にデザインする必要があります。上流と下流のPCRプライマーが同一のエクソン内にアニールするとDNAおよびRNA由来のターゲットが共に増幅します。反対に、プライマーが隣接するエクソン上にアニールすると、通常cDNAのみが増幅されます。その理由はゲノムDNA由来のアンプリコンがイントロン配列を含むため、リアルタイムPCRに使用される条件下で効率的に増幅されるにはアンプリコンが長くなりすぎるためです。
偽遺伝子、またはサイレント遺伝子は、プライマーをデザインする場合に考慮するべき転写変異です。これらの遺伝子は、プロモーターまたは遺伝子自体における変異または再配列により非機能的となった、現存遺伝子の発現誘導体です。プライマーデザインソフトウェアプログラムはBLAST検索を実行し、偽遺伝子およびそのmRNA産物を避けることが可能です。
アレルバリアントは同一の染色体座にある、2つ以上の特徴的な遺伝子型です。これらのバリアントからの転写産物間には1つ以上の変異の違いがあります。プライマーデザインにおいてアレルバリアントを考慮する必要性があるかどうかは、1つ以上の変異がデザインする配列内に存在するかどうかによって決まります。さらに、バリアント間のGC含量の差が増幅効率を変動させ、融解曲線に分離したピークが生成する可能性もあり、非特異的な増幅と間違って判断される可能性もあります。プライマーデザインにおいては、交互に接合したバリアントも考慮に入れる必要があります。
プライマーおよびプローブの特異性、ダイマー形成および自己ヘアピン形成
プライマーダイマーは、フォワードプライマーとリバースプライマーの間の相互作用により最も頻繁に生じますが、フォワードプライマー同士またはリバースプライマー同士のアニーリング、または単一のプライマーがヘアピンを形成することによっても起こり得ます。プライマーダイマーは、マルチプレックスリアルタイムPCRのように、より複雑な反応において大きな問題です。ダイマー形成が互い違いに起こることは実際頻繁に見られる現象ですが、その結果ある程度の伸長が起こり、意図するアンプリコンのサイズに近づき、サイクルが進むにつれて増幅する産物が生成する可能性があります。一般的に、PCR反応の開始時点のターゲットの量が少ないほど、プライマーダイマーの生成の可能性は高くなります。しかし一般的に、プライマーダイマーの生成は目的のプライマーとテンプレートとの相互作用より起こりにくくなり、またこの現象を最小限に抑制または排除する方法が多数存在することは、この問題のポジティブな側面です。
プライマーダイマーに関する主な問題は、偽陽性結果を生じる可能性があることです。この点は、SYBR Green I 色素などのDNA結合色素を使用する反応においては特に問題です。もう一つの問題点は、プライマーダイマー生成に起因する反応の競合により、反応効率が好ましい範囲である90%~110%の範囲を超えてしまう可能性があることです。最後の主な問題点である増幅反応のダイナミックレンジの狭域化もまた反応効率に関連しており、反応の感度に影響を及ぼす可能性があります。プライマーダイマー自身からシグナルが発生していない場合においても(TaqMan Assay の場合のように)、効率およびダイナミックレンジは影響を受ける可能性があります。
構築したPCRプライマーデザインを解析し、それらがダイマー形成や自己ヘアピン形成を起こしやすいかどうかを決定するいくつかの無料のソフトウェアをご利用になれます。
AutoDimer プログラム(米国国立標準技術研究所のP.M. Vallone 著)は、プライマーの全リストを同時に解析することが可能なバイオインフォマティクスのツールです(図2)。このソフトウェアは、特にマルチプレクシングにおいて有用です。プライマー配列のバイオインフォマティクス解析は、ダイマー生成のリスクを大きく低減させることが可能ですが、ダイマー形成を実験的にモニターすることも必要です。
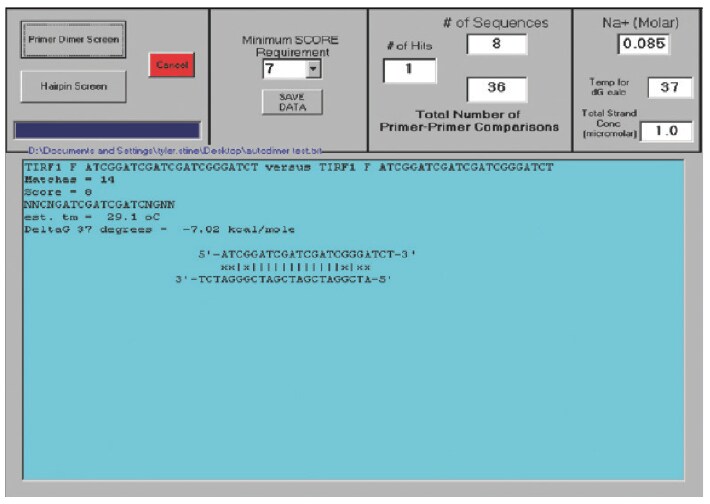
図2 AutoDimerからのスクリーン。このソフトウェアは、プライマー配列を解析し、プライマー内において二次構造の存在の可能性がある領域(プライマー自身の折り畳みを生じる可能性がある領域)またはプライマーがお互いにアニールする可能性のある配列部分をレポートします。
プライマーダイマーをスクリーニングする従来の方法であるゲル電気泳動法においては、プライマーダイマーは、ゲルの底部付近に、広がった不鮮明なバンドとしてあらわれます(図3)。ゲルによる検証の問題点の一つは、感度が高くないため結論が曖昧になる可能性があることです。しかし、ゲル解析はプライマーダイマーの検出の最良の方法であると考えられている、融解・熱解離曲線から得られたデータの検証に有用です。
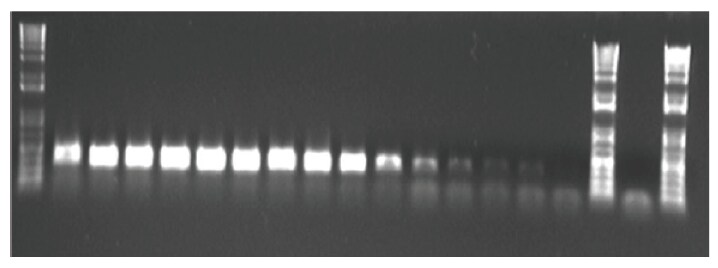
図3 プライマーダイマー形成を検討するためのアガロースゲル解析。サーマルサイクル反応に先立って、核酸試料を段階希釈してPCRミックス成分に添加し、同一容量の各混合物をアガロースゲルにロードしました。プライマーダイマーは、ゲルの底部に広がったバンドとして現れています。
検出にDNA 結合色素を使用するすべてのリアルタイムPCRでは、ランに続いて融解または熱解離曲線を作成する必要があります。装置によりDNAが二本鎖で蛍光が高い状態である低温度から、DNAの変性により蛍光が低くなる高温度へと温度を上昇させます。PCR中に生成される各PCR産物のTmにおいて、蛍光の急激な低下が観察されます。テンプレートを含まないコントロール(NTC)において得られる融解曲線のピークとターゲットから得られるピークと比較することにより、プライマーダイマーが反応中に存在するかどうかが確認できます。
理想的には、テンプレートを含む各反応に単一の特徴的なピークが観察され、NTCにおいてピークは観察されないことが望ましいです。期待されるアンプリコンよりも低いTm値にある、より小さく幅の広いピークで、NTC反応においても観察されるピークは、ほとんどの場合プライマーダイマーに由来するものです。さらに、反応産物のゲル電気泳動により、融解ピークに相当する反応産物のサイズを検証することも可能です。
プライマーダイマーが存在していても、リアルタイムPCRアッセイ全体としての精度には影響を与えない場合もあります。プライマーダイマーがテンプレートを含まないコントロールには存在し、テンプレートDNAを含む反応には現れない場合が多く観察されます。テンプレートが存在しなければプライマー同士が相互作用する確率がより高くなることから、この現象は当然のことです。テンプレートが存在すると、プライマーダイマーの形成は起こりにくくなります。NTCにおいて観察されるピークがテンプレートを含む反応の融解曲線に現れない限り、プライマーダイマーは問題となりません。
プライマーダイマーは、プライマーが不完全マッチの予期しない位置にアニールすることにより生成するアンプリコンを含む、広い意味での非特異的PCR産物の一部であるといえます。非特異的産物の増幅が問題となるのは、それらが蛍光に影響を与え、結果として反応のCtを擬似的にシフトさせるためです。非特異的産物は反応成分への競合により反応効率に影響を与え、その結果ダイナミックレンジおよびデータの精度を低下させます。非特異的産物は、正確なコピー数を求める絶対定量アッセイにおいてはさらに大きな問題です。
一般的にはゲル電気泳動がリアルタイムPCRの特異性を確認するための初めのステップです。ゲル電気泳動はターゲットアンプリコンと異なるサイズの産物を同定するためには有用ですが、近い大きさのアンプリコンは識別できず、その感度は制限されています。融解曲線解析は、その精度および感度から、プライマーの特異性をゲル電気泳動を用いて評価した確認結果が非常に信頼できるか判断できます。
非特異的増幅は、できるかぎり常に排除することが望ましいですが、このような二次産物の存在が常に大きな問題とはならない場合もあります。例えば、異なるアイソフォームまたはGC含量の異なる複数のアレルをあえてターゲットとする場合には、複数の産物の生成が予想されます。
プライマーデザインの留意事項
リアルタイムPCR用のプライマーのデザインに関する留意事項を以下に示します。Invitrogen™ Vector NTI™ Softwareの配列解析ソフトウェアなどのプライマーデザインソフトウェアプログラムは、弊社のオンライン注文システムに直結していますので、配列をカット・アンド・ペーストする必要も一切ありません。これらのプログラムは、以下のガイドラインを組み込んだアルゴリズムを使用して、特定の遺伝子またはターゲット配列用のプライマーを自動的にデザインし、さらに既知の配列、相同配列に関するゲノム全体のBLAST検索も行うことが可能です。
- 通常、18~28のヌクレオチド長のプライマーをデザインする。
- 繰り返し塩基配列を避ける。
- ミスマッチ配列が安定してハイブリするのを防ぐために、50%のGC含量を目標とする。
- Tm値が近い(お互いに2°C以内)プライマーを選択する。
- アッセイに使用するすべてのプライマー間および各プライマー内の配列的相補性を避ける。
リアルタイムPCRハンドブック 無料ダウンロード
このハンドブックでは、リアルタイムPCRの理論や実験デザインの設計など、リアルタイムPCRの基礎知識が掲載されています。リアルタイムPCRを始めたばかりの方やこれから実験を考えている方にうってつけのハンドブックです。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
リアルタイムPCRトラブルシューティング 無料ダウンロード
異常なS字状の増幅曲線、NTCでの増幅検出、増幅が見られないなど、リアルタイムPCRの実験中に困った際の手助けになる情報を紹介しています。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
研究用にのみ使用できます。診断用には使用いただけません。