これまで、実験の不整合性を排除することがリアルタイムPCR実験のデザインにおいて極めて重要であることをご紹介してきました。実験計画から逸脱してしまうと、データの比較が制限され、偏差を考慮に入れずに解析を行うと誤った結論につながる可能性もあります。実験上の変動要因は、テンプレートの品質および量、RNA精製方法、逆転写そして勿論リアルタイムPCRの増幅も含まれます。本質的には、標準化とはこれらの原因に由来する変動の影響を中和する方法です。リアルタイムPCRの各段階において、それぞれ個別の標準化法が存在しますが、効果はそれぞれ異なります。今回は、リアルタイムPCRにおけるさまざまな標準化法についてご紹介します。
▼もくじ [非表示]
試料の量の標準化
同量の試料、例えば組織または細胞を使用してRNAまたはDNA精製を行うことにより、変動を最小限に抑えることは可能ですが、大まかにしかできず、RNA精製のバイアスには対処できません。
RNAまたはDNAの量の標準化
RNA試料またはDNA試料の正確な定量および品質の評価は必要ですが、RTおよびリアルタイムPCR反応の効率の差の調整にはならないため、唯一の標準化法としては不十分です。例えば、阻害物質の量のわずかな差がRT反応に影響を及ぼし、増幅効率を低下させる可能性があります。試料中に存在する変動要因はPCR反応によってすべて増幅されます。このため試料中の生物学的条件とは無関係に、大幅な変化が生じる可能性があります。ピペッティングも手技による変動要因の一つとなり、精製後のRNA解析によって標準化できません。
コントロール遺伝子での標準化
ノーマライザー遺伝子(コントロール遺伝子または内在性コントロールとも称されます)の使用は、リアルタイムPCRにおける変動のほとんどすべての原因に対処する最も完全な方法です。しかし、この方法では、比較されるすべての試料中にこの遺伝子が一定量存在していることが必要です。効果的なノーマライザー遺伝子は、RNAの品質と量、およびRTとリアルタイムPCR両者における増幅効率の差を標準化します。もし2つの異なる試料において、ターゲットの逆転写またはDNAポリメラーゼによる増幅が異なる速度で進行した場合には、ノーマライザーの転写がこれらの変動を反映します。ノーマライザー遺伝子には“ハウスキーピング”遺伝子などの内在性のコントロール遺伝子または外在性の核酸ターゲットが使用できます。
内在性コントロール
リアルタイムPCRにおける一般的な内在性ノーマライザー遺伝子は以下の通りです。
- β-アクチン(ACTB):細胞骨格遺伝子
- 18SリボソームRNA(rRNA):リボソームサブユニット
- シクロフィリンA(CYC):セリン・トレオニンフォスファターゼ阻害剤
- グリセルアルデヒドリン酸デヒドロゲナーゼ(GAPDH):解糖系
- β-2-マイクログロブリン(B2M):主要組織適合性複合体
- β-グルクロニダーゼ(GUS):リソソーム中のエキソグリコシダーゼ
- ヒポキサンチンリボシルトランスフェラーゼ(HPRT):プリン再利用経路
- TATA-Box結合タンパク質(TBP):RNA転写
すべてのリアルタイムPCR実験はそれぞれ異なるため、熟慮と綿密な計画のもとノーマライザーを選択することが必要です。他の研究室で何が使用されているかに基づいてノーマライザーを選択するのではなく、選択したターゲットの定量法に最もよく適応するノーマライザーを選択してください。
品質が高いノーマライザーの第一条件は、存在量がターゲットの遺伝子産物と同等であることです。マルチプレクシングにおいては特に重要で、ターゲットがCtに到達する前にノーマライザーがプラトーに達してしまうと、ターゲットのCt値が高くなりノーマライザーの意味がなくなります。一方で、ノーマライザーの反応を発現量が低い反応系にあわせるためにプライマーリミットの条件を構築することが可能です。ほとんどのApplied Biosystems™ TaqMan™ Endogenous Control Assayは、プライマーリミット用の形態で入手することが可能です。
ノーマライザーターゲット用のリアルタイムPCRアッセイは、実験ターゲット用のアッセイと同様の増幅効率を有することが必要ですが、この点は検量線を使用して評価できます。効率の異なる反応を比較する場合には補正することも可能ですが、反応効率がお互いに近似している方が精度が向上します。
最後に最も重要な点として、ノーマライザーの発現は試料の処理法または疾患状態にかかわらず一定であることが必要です。この点は図に示すように、実験的に決定する必要があります。
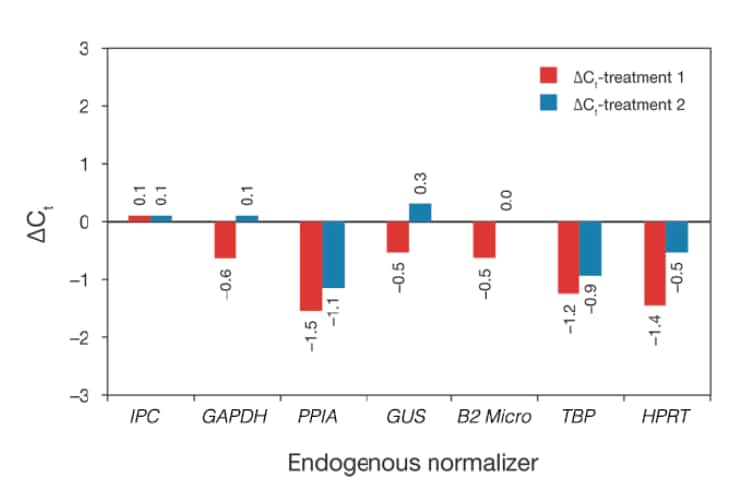
図 一般的に使用される内在性コントロールの遺伝子発現量と、標準化の重要性。この例では、2つの処理群と1つの正常群に関して、内部陽性コントロール(IPC)とともに増幅した一般的なコントロール遺伝子の発現量を解析しました。IPCは正常な反応間の変動の標準値をしめします。ΔCtが0である正常試料と比較した、各処理群におけるノーマライザーの発現レベルの変動を棒グラフで表しています。目的は、IPCが示す変化と同様の変化を示すノーマライザーを見つけることです。
複数の反復実験をくりかえすことで正確な結果であることが保証されますが、シクロフィリン、TBPおよびHPRTは、処理により発現レベルが下がっているように見えるため、これらの処理群に関しては良好なノーマライザーの選択肢ではないことが明らかです。最も一般的なコントロール遺伝子の発現量でも、一定の条件下では変化することがありますので、常に検証を行うことが必要です。
- GAPDHは多くの例において一貫性を示す一般的なノーマライザーです。しかし、いくつかの癌細胞、腫瘍抑制因子で処理した細胞、低酸素状態およびマグネシウムまたはインスリン処理した試料においては、過剰発現されることが知られています。
- β-アクチンは、ほとんどの細胞型において比較的十分な発現量を示すため、一般的に使用されているもう一つのハウスキーピング遺伝子です。しかしその一貫性は、乳房上皮細胞、割球、ブタ組織およびイヌ心筋など多くの条件下で疑問視されています。
- 18S rRNAは細胞の総RNAの85%~90%を占め、その量はラット肝臓、ヒト皮膚線維芽細胞およびヒトとマウスの悪性細胞株において非常に一貫性があります。しかし、中程度または低い発現量のターゲットの標準化には、その存在量が問題です。18S rRNAで十分なレンジのベースラインが得られ、かつ研究対象のターゲットが40サイクル以内にCtに達するようなRNA濃度を見つけることは多くの場合困難です。さらに、マルチプレックス反応においては、ノーマライザーが研究対象ターゲットのPCR効率を低下させないように、18S用プライマーの濃度を制限することが必要です。
単一のコントロール遺伝子の精度に依存せず、複数の検証済みノーマライザーの幾何学的平均値を利用する代替法も存在します。複数の安定したノーマライザーを使用するこの方法は、あらゆる単一遺伝子のCt 変動をより効果的に和らげ、利用できるアッセイおよび試料タイプの範囲を広げる可能性があります。
外来性ノーマライザー
外来性ノーマライザーの使用はあまり一般的ではありませんが、特定の試料セットに対して一貫性の高い内在性ノーマライザーが見つけられない場合に使用可能な代替法です。外来性コントロール遺伝子は、実験試料中に含まれない配列を有する、合成RNAまたはin vitro転写RNAです。外来性であるため、異なる条件または処理において細胞内に生じる可能性のある生物学的変動の影響は受けません。外来性ノーマライザーを使用する場合、実験ワークフローのより早い段階において添加すると、より多くのステップにおけるばらつきを標準化することが可能です。例えば、外来性の転写物を細胞溶解バッファーに添加すると、細胞溶解、RNA精製およびそれに続くRTおよびPCR反応用のノーマライザーとして使用できます。
外来性ノーマライザーの例としては、光合成遺伝子など植物機能に特異的遺伝子の、in vitro転写RNAが使用されることがあります。哺乳類細胞にはこれと同じ転写物が存在しないため、このノーマライザーは哺乳類の試料に添加することが可能です。
外来性ノーマライザーの問題点を以下に示します。
- 内在性ではないということです。ワークフローの初期、例えば細胞溶解バッファー中に添加することにより、外来性ノーマライザーを最大限に活用できます。
- ノーマライザーを添加する際、ピペッティングの精度が結果に影響を及ぼします。
- 転写物の安定性は、長期保存および凍結・融解の繰り返しにより影響を受ける可能性があります。このため、コピー数を定期的に評価し、時間経過とともにコピー数が変化していないことを確認する必要があります。
【無料ダウンロード】リアルタイムPCRハンドブック
このハンドブックでは、リアルタイムPCRの理論や実験デザインの設計など、リアルタイムPCRの基礎知識が掲載されています。リアルタイムPCRを始めたばかりの方やこれから実験を考えている方にうってつけのハンドブックです。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
【無料公開中】リアルタイムPCRトラブルシューティング
異常なS字状の増幅曲線、NTCでの増幅検出、増幅が見られないなど、リアルタイムPCRの実験中に困った際の手助けになる情報を紹介しています。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
研究用にのみ使用できます。診断用には使用いただけません。



