近年、細胞や微生物を用いて医薬品を製造するバイオマニュファクチャリングが盛んになっています。それに伴い、細胞や微生物の培養に用いられる設備も、ステンレスタンクからシングルユース製品への切り替わりが進み、バイオ医薬品製造のシードトレインの多くがシングルユースシステムを使用して生産効率も向上しています。今回は動物細胞培養の上流工程の連続生産とその事例についてご紹介します。
▼こんな方におすすめです!
- バイオプロセシングのトレンドについて知りたい
- 動物細胞培養工程について知りたい
- パーフュージョン培養/連続生産プロセスについて知りたい
- プロセス開発から商用規模のスケールアップについて知りたい
バイオプロセシングの上流工程の動向
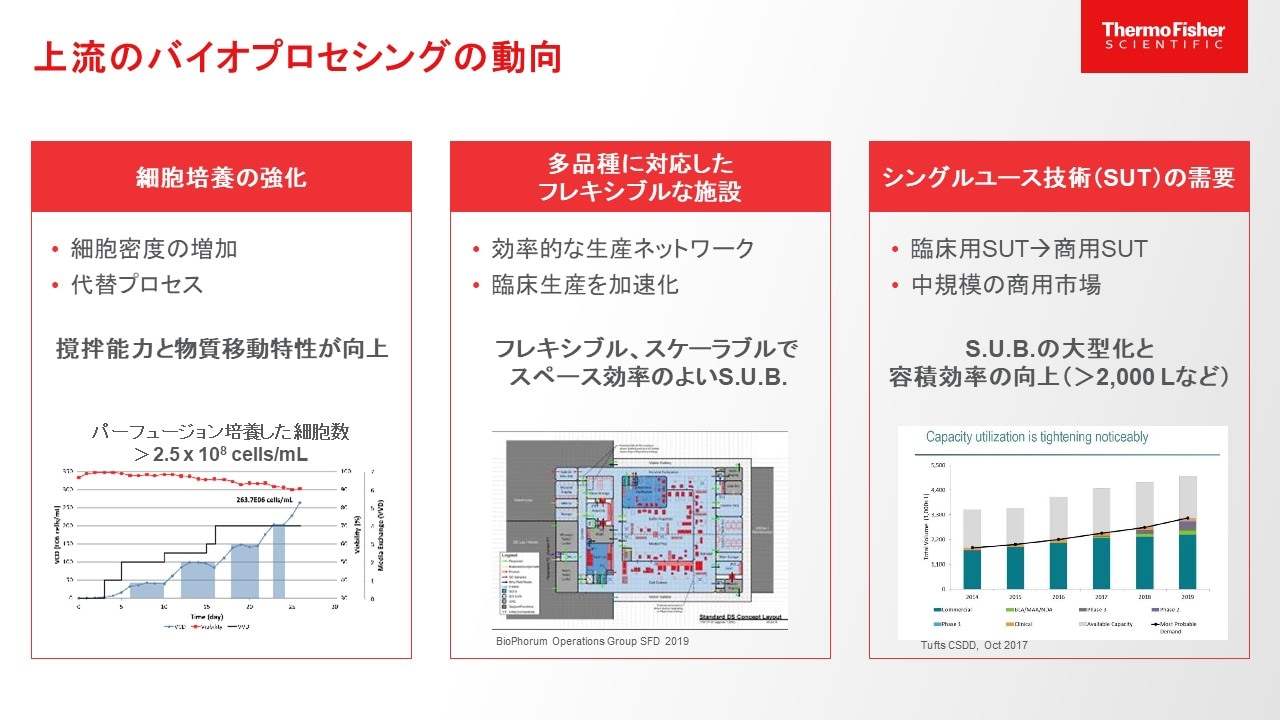
図1.バイオプロセシングの上流工程の動向
動物細胞培養を含む上流工程にシングルユースシステムを導入することで、各バッチに最適なオペレーションを採用できます。例えば、一つのシングルユースバイオリアクターを使用して、フェッドバッチ培養とパーフュージョン培養も両方行う、異なる種類の細胞培養に使用する、シングルユースバッグのデザインをプロセスに合わせて変更する、といったことが可能です。また、バッチ切り替えはシングルユース部分を付け替えるだけで完了するので、生産時間の短縮につながります。ステンレスシステムの場合、洗浄・滅菌を含めた設備が必要となり、設備投資に要する費用が大きくなりますが、接液部分がシングルユースであれば、シングルユースバッグやチューブなどを付け替えるだけで無菌状態にできるので、初期投資額も抑えられると同時にクロスコンタミネーションのリスクをかなり低減することができます。
シングルユース製品の普及に伴い、アップストリーム工程で使用される次世代シングルユースバイオリアクターに対するニーズも高まってきています。その背景には高密度培養が可能な細胞種の開発やパーフュージョン培養といった代替プロセスの開発が挙げられ、その結果、高密度培養に対応できるように高い撹拌能力と物質移動特性(kLa)が求められるようになりました。また、さまざまな製品を製造できるよう、多様な培養方法や細胞種に対応可能なフレキシブルな設備が求められているだけでなく、拡大培養のしやすさやスペース効率も重要視されています。従来、主にシングルユース製品は治験薬製造までの段階で活用されていましたが、近年では商用レベルでもシングルユース製品が導入されてきており、2,000 L以上の大型なシングルユースバイオリアクターの需要が高まっています。このことから、大容量の培養が可能でありながら、設置スペースを取らない、パフォーマンスの高いバイオリアクターが求められているといえます。
連続生産のプロセス(上流工程)

図2.連続生産プロセス(上流工程)の概要
図2は、上流工程の連続生産プロセスを示しています。連続生産の場合、動物細胞培養工程はATFもしくはTFFを用いたパーフュージョン培養が採用されることが一般的です。培養液中に含まれる目的物質を培地ごと抜き取り、代わりにフレッシュな培地を継ぎ足すことで長期間細胞培養を継続するパーフュージョン培養には、主に次の利点があります。
- 細胞を長期間健康な状態で培養可能
- 目的物質の品質向上
- 設備稼働効率の向上
- 生産スケール調整が容易
一方で、培地を多く使用することによる費用の増加や規制が未整備であることなど、課題も多く存在します。その一例を以下に示します。
- 原材料の増加による費用増加
- 連続生産技術の発達が発展途上
- 連続運転による人件費の増加
- 規制が未整備
つまり、連続生産に対する規制環境の整備と技術開発が求められていると言えます。
パーフュージョン培養では、バイオリアクターで細胞培養を行い、栄養の枯渇した培地をATFを通して抜き取ります。この時、ATFを通過するのは目的物質と培地で、細胞はバイオリアクター内にとどまります。目的の細胞密度に達した後は、細胞密度を維持するためにブリードラインから細胞を抜き取り調整する必要があります。キャパシタンスセンサーをバイオリアクター側のコントローラーにインテグレーションすることで、常時細胞密度をモニタリングできるようになり、細胞密度の管理が容易になります。
培地交換量は培地や細胞の特性、プロセスによって異なりますが、1日ごとにベッセル内の培地をすべて入れ替える場合、500 Lのバイオリアクターで60日間培養するためには、3万Lの培地が必要になります。しかし、一度に3万Lの培地を調製することはできないため、シングルユースミキサーにて複数回にわたって培地調製を行う必要があります。調製後は、フィルターろ過して貯留タンクに入れて保存し、必要量をバイオリアクターへ投与します。
事例紹介:CHO細胞のパーフュージョン培養
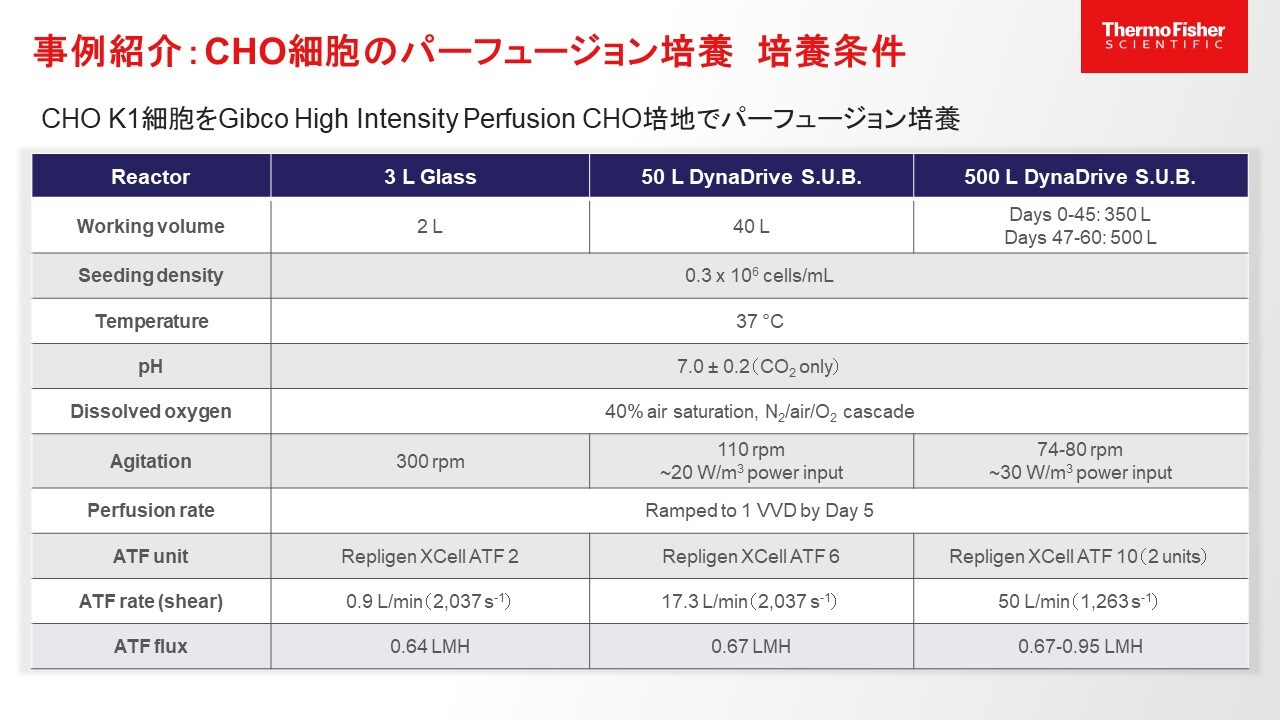
図3.事例紹介:CHO細胞のパーフュージョン培養の培養条件
Thermo Scientific™ DynaDrive™シングルユースバイオリアクター(S.U.B. )およびThermo Scientific™ HyPerforma™ベンチトップ型ガラス製バイオリアクターにてパーフュージョン培養を実施した際のデータを示します。使用したリアクターは、3 Lのガラスバイオリアクター、50 L DynaDrive S.U.B.、500 L DynaDrive S.U.B.の3種類で、細胞種はCHO-K1細胞、培地はパーフュージョン培養用培地であるGibco™ HIP CHO培地を使用しております。培養条件は表に示した通りですが、細胞播種密度、温度、pH、溶存酸素濃度は3つのリアクター間で統一されています。培養液量は3 Lのガラスバイオリアクターでは2 L、50 L DynaDriveでは40 L、500 L DynaDriveでは培養開始から45日までは350 L、その後培養液を増やし60日まで500 Lにて培養しています。500 L DynaDriveの撹拌速度は、培養液量が350 Lの時は74 rpm、その後培養液を増やした時点で80 rpmに上げています。パーフュージョン率は5日以降は1 VVDで統一されています。ATFもバイオリアクターサイズによって変わる点ですが、今回はガラスバイオリアクターではRepligen Xcell ATF2, 50 LではATF6, 500 Lでは2台のATF10を使用しており、shear rateと流速を適宜調整しています。
長期間パーフュージョン培養を行う場合、ATFや排気ラインのフィルターの詰まりが懸念されますが、500 L DynaDriveにて60日間培養を行った際にATFやベントフィルターの詰まりはなく、培養開始前にセットしたもので60日間の培養ができています。
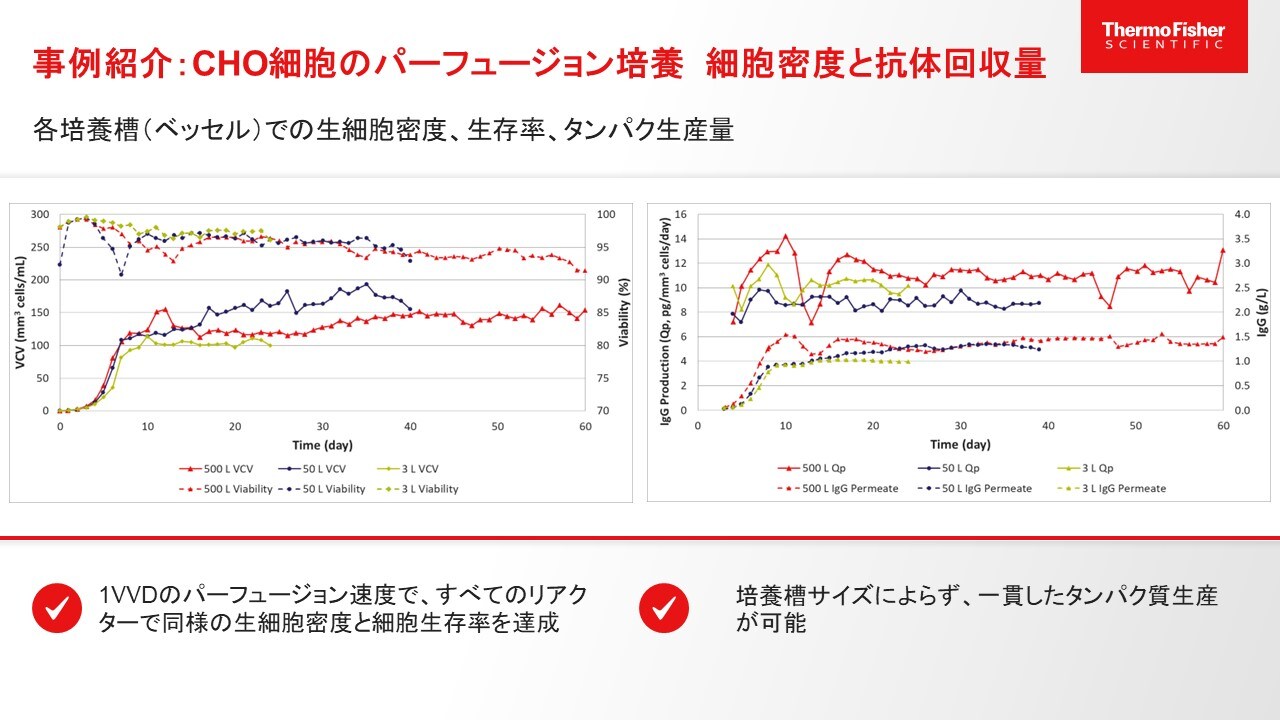
図4.事例紹介:CHO細胞のパーフュージョン培養 細胞密度と抗体回収率
上図のグラフ内、実線で生細胞密度、点線で細胞生存率を示しています。赤が500 L DynaDrive、紺が50 L DynaDrive、緑が3 Lベンチトップ型ガラス製バイオリアクターの結果です。生細胞密度では50 L DynaDriveで若干上振れしていますが、全てのスケールで100 mm3 cells/mLを維持できており、細胞生存率は常時90%以上を維持していることから、1 VVDのパーフュージョン速度ですべてのリアクターでターゲットとした生細胞密度と細胞生存率を維持することができています。
右のグラフでは目的タンパク質の生産量とQpを示しています。実線がQp、点線がIgGの生産量で、培養槽(ベッセル)のサイズにかかわらず、同等のタンパク質生産ができていることが示されています。
まとめ
今回は、上流のバイオプロセシングの動向とシングルユースバイオリアクターに対するニーズに加え、連続生産とその培養事例についてご紹介しました。CHO細胞のパーフュージョン培養からもわかるようにDynaDrive S.U.B.では、100 x 106 cells/mL以上の細胞密度を維持し、60日間のパーフュージョン培養が可能であり、すべてのサイズ間でスケーラビリティが維持され、プロセス開発から商用規模までのスケールアップを可能とし、近年需要が高まっている連続生産のプロセスの構築に貢献できることがわかります。
今回ご紹介したパーフュージョン培養についてさらに詳しく知りたい方のために無料でダウンロードできるシングルユースパーフュージョン培養eBookをご用意しています。
ファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
【無料ダウンロード】シングルユースパーフュージョン培養eBook
研究用または製造用にのみ使用できます。診断目的の使用、ヒトおよび動物への直接的な使用はできません。