DNAを凍結保存するときに、気をつけていることはありますか?RNAと比較するとDNAは分解しにくい物質なので、そこまで気にせず凍結保存することが多いのではないでしょうか。今回は、リアルタイムPCRの検量線やポジティブコントロールに用いることもある、合成DNAをサンプルとして、長期間凍結保存する際の影響を調べてみました。
はじめに
DNAを凍結保存するときに気にするべきパラメーターとしては、保存温度(-80℃、-20℃、4℃)、保存溶媒(乾燥、水、TEバッファー)、凍結融解回数などが挙げられます。この他にも、保存濃度やDNAのチューブへの吸着も気をつけたいポイントです。今回は、DNAを長期間凍結保存する際の温度と、チューブへの吸着に着目した実験をやってみました。核酸の吸着を防ぐ一般的な方法の1つは低吸着性チューブの利用ですが、Yeast tRNAにもサンプルの吸着を防止する効果があるということなので検証してみました。
材料と方法
保存するDNAはInvitrogen™ GeneArt™ Strings DNA Fragmentsサービスを利用して合成しました。乾燥品として届いたDNAを107コピー/µLになるように調製しました。この調製時には、Invitrogen™ Yeast tRNA (10 mg/mL)を終濃度10 µg/mLになるように加えたものと加えないものを用意し、2020年5月14日に-80℃もしくは-20℃にて保存を開始しました。2021年の9月28日に実験を実施しましたので、502日間保存してみました。
保存開始から502日後に1度だけ融解し、10倍希釈系列(107コピー/5 µLから100コピー/5 µLまで)を調製してリアルタイムPCRを実施しました。凍結保存した影響はCT値を比較することで評価しました。リアルタイムPCRには、Applied Biosystems™ QuantStudio™ 5 Real-Time PCR System, 384-well を使用しました。厚生労働省がとりまとめた食安監発第1105001号(ノロウイルスの検出法)を参照し、ノロウイルスG1検出用プライマー・プローブ配列を使用しました。当初に合成したサンプルDNAは、このプライマー・プローブで検出される170 bpのもので、下記のようにリアルタイムPCRを実施しました。
| リアルタイムPCR反応液 | (μL) |
| GeneArt™ Strings DNA | 2.5 |
| Applied Biosystems™ TaqPath™ qPCR Master Mix, CG | 5.0 |
| 20X TaqMan primer probe mix (ノロウイルス G1) | 0.5 |
| Nuclease-Free Water | 2.0 |
| Total | 10.0 |
※ウェル間で調製誤差が生じないようにするため、必要本数分まとめて調製しました。
条件:
1. 50℃ 2 min
2. 95℃ 20 sec
3. 60℃ 15 sec
4. 56℃ 1 min
※3~4を45 cycle 反復
結果と考察
保存温度の影響
まず、長期保存した際の温度のみの影響を比較してみましょう。Yeast tRNAを添加することなく-80℃もしくは-20℃でDNAを約500日間保存し、そのサンプルDNAの10希釈系列についてリアルタイムPCRを実施しました。その結果、どのコピー数でも-80℃の方がCT値が低く、比較的安定して保存できていたことが分かりました(表1、図1)。普段、DNAは-80℃で保存することはあまりないかもしれませんが、こうして比較してみるとより低い温度の方が安定して保存できそうです。このような保存温度におけるCT値の差は、DNAが分解したからなのでしょうか?それともDNAのチューブへの吸着の影響なのでしょうか?
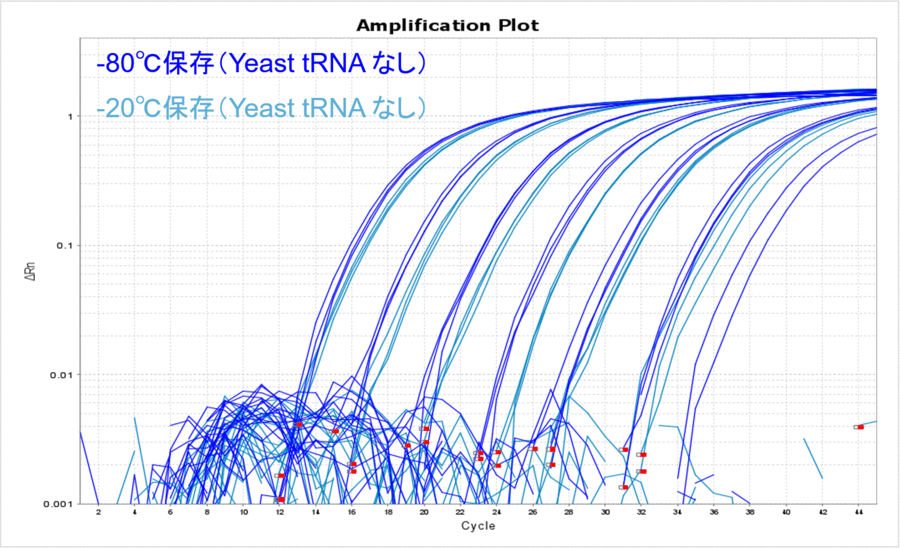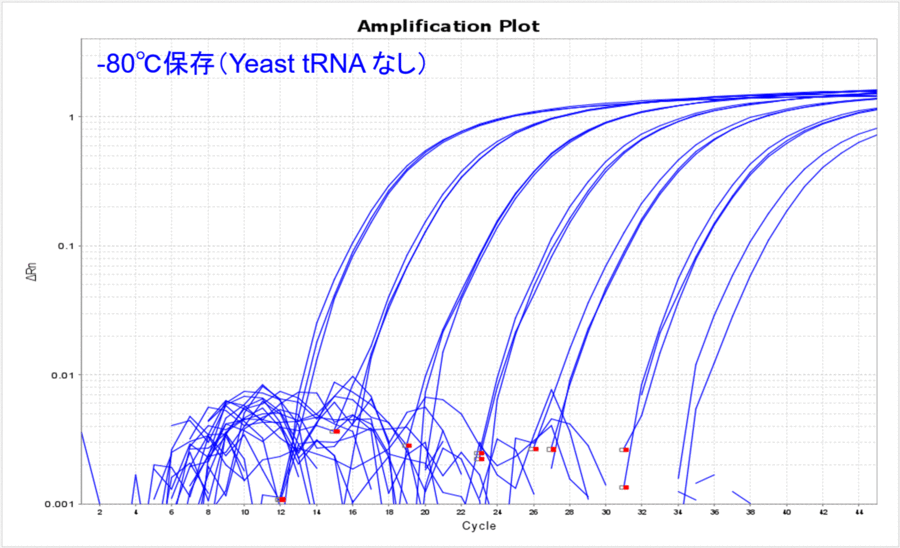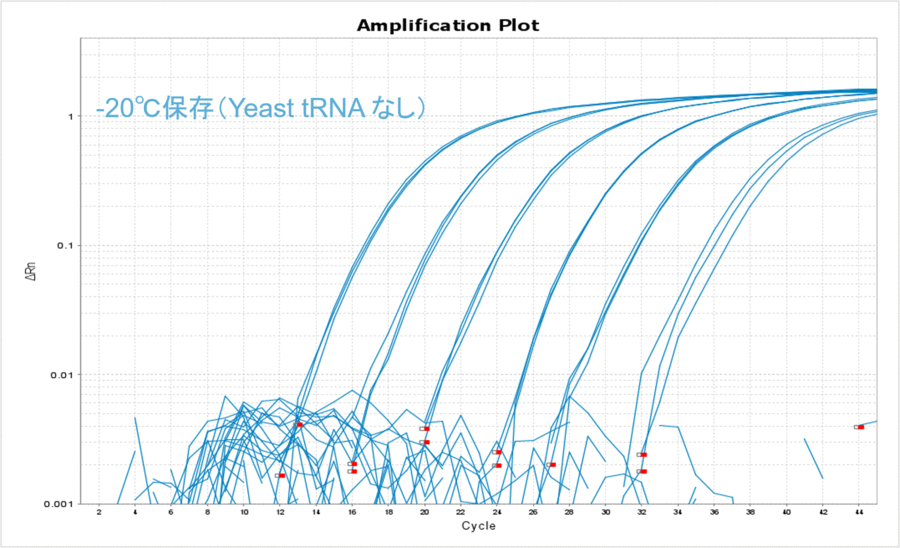
図1
Yeast tRNAの効果
終濃度10 µg/mLになるようにYeast tRNAを添加したサンプルで、上記と同じ実験を実施しました。Yeast tRNAを添加すると、保存温度の影響がほとんどなくなりました(表2、図2)。さらに、各コピー数のCT値がYeast tRNAを添加しない場合と比較して低くなったことから、Yeast tRNAを添加すると保存温度にかかわらずサンプルDNAを安定的に保存できることがわかりました。

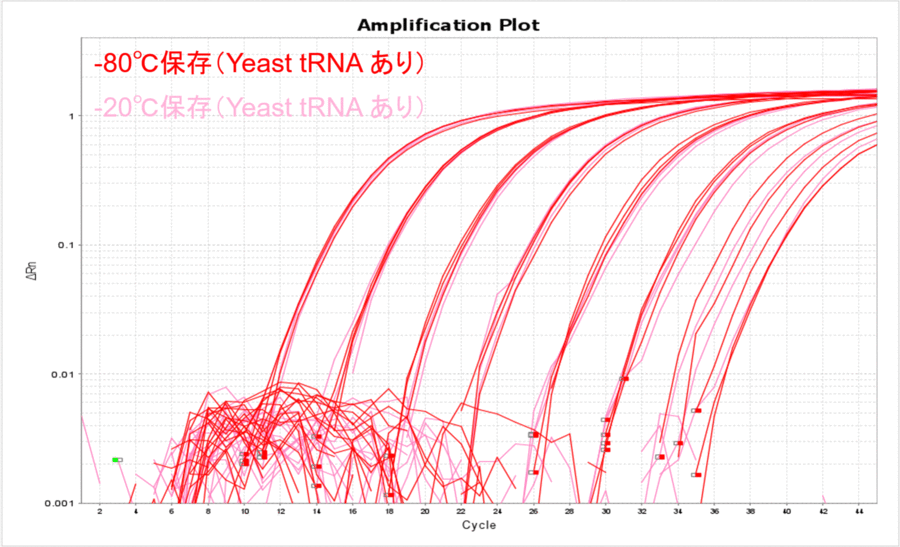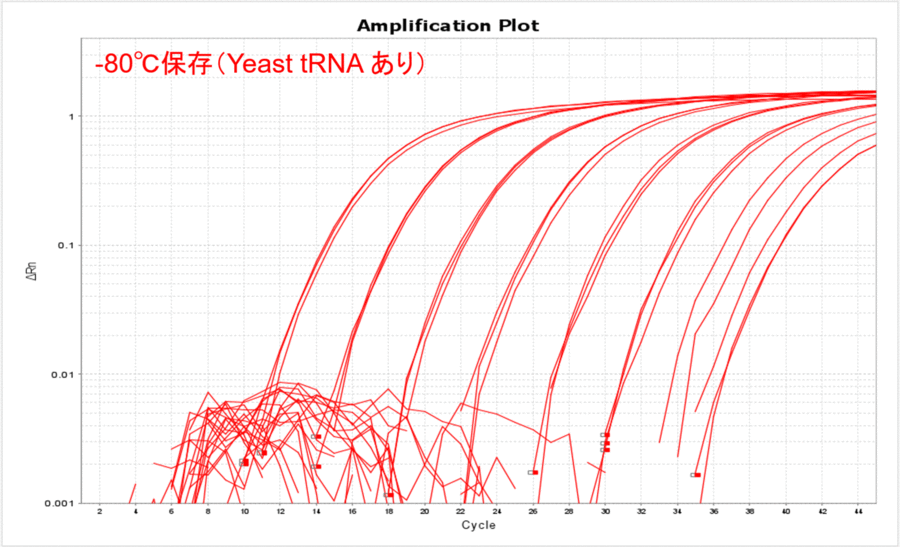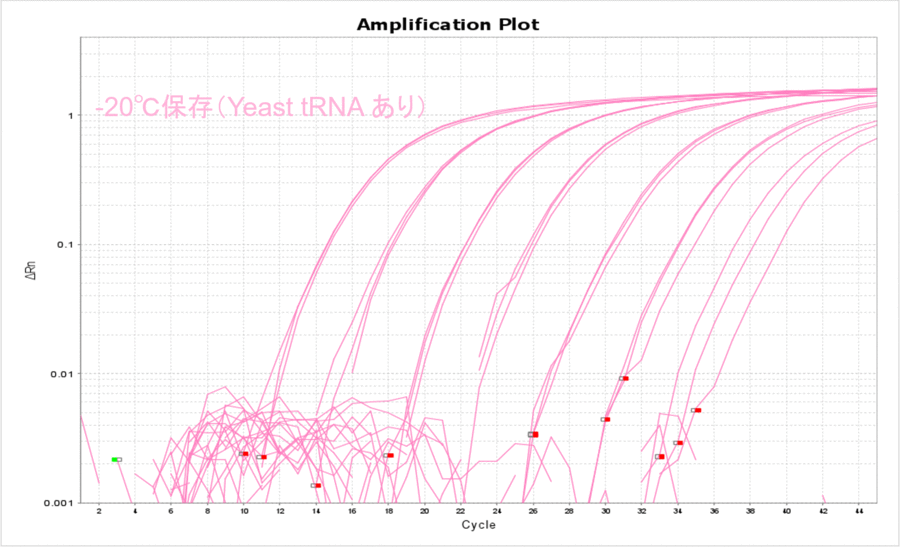
図2
-80℃で保存した場合のYeast tRNA添加の有無を比較してみると、Yeast tRNAなしの場合はCT値が高くなり、リアルタイムPCRで検出できるサンプル量が目減りしていることがわかりました(表3、図3)。希釈する前のDNAサンプルは、凍結融解を1度もすることなく-80℃で保管していたものなので、DNAの分解というよりはDNAのチューブへの吸着をYeast tRNA添加によって防げたことを示唆している結果だと考えました。

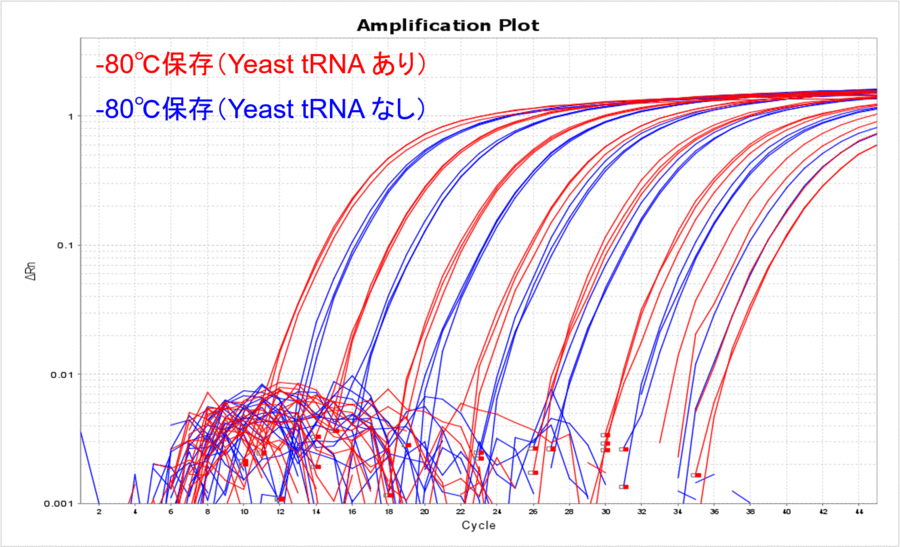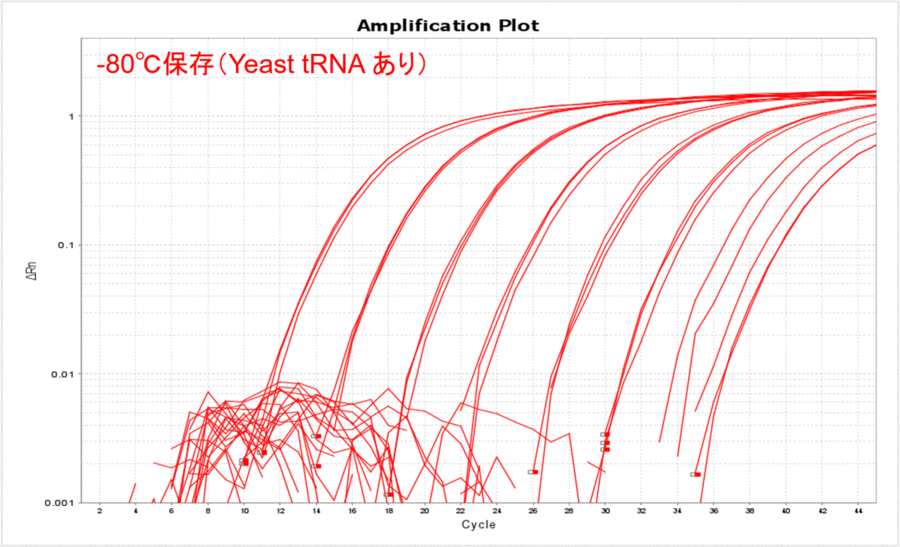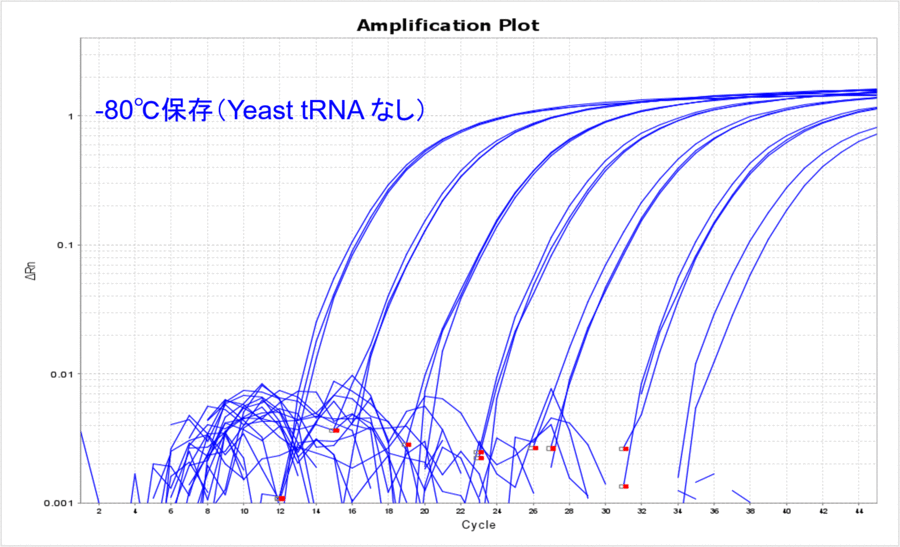
図3
-20℃で保存した場合もYeast tRNAありの条件で安定的に保存できることがわかりました(表4、図4)。また、-80℃で保存した場合のΔCT値と比較して数値が大きくなったことから、-20℃保存の方がDNAのチューブへの吸着が多くなったのだろうと予想されました。

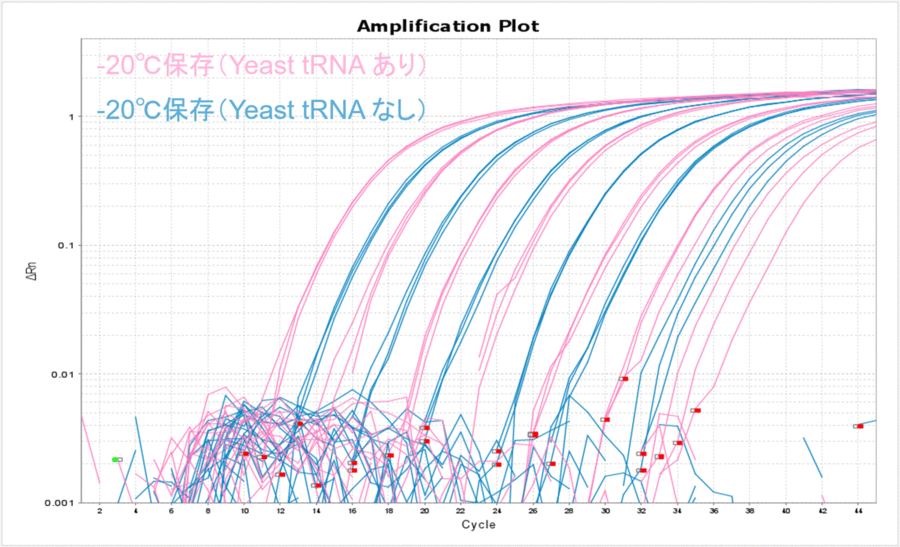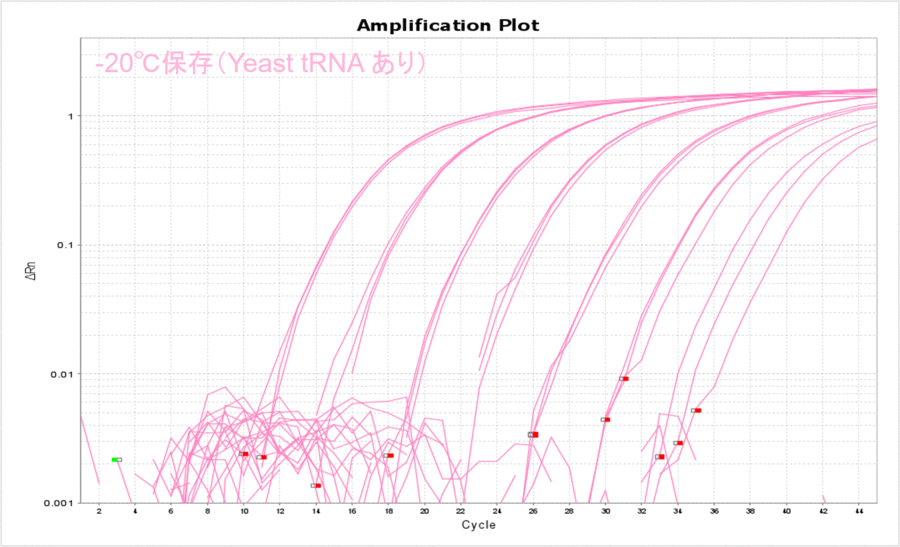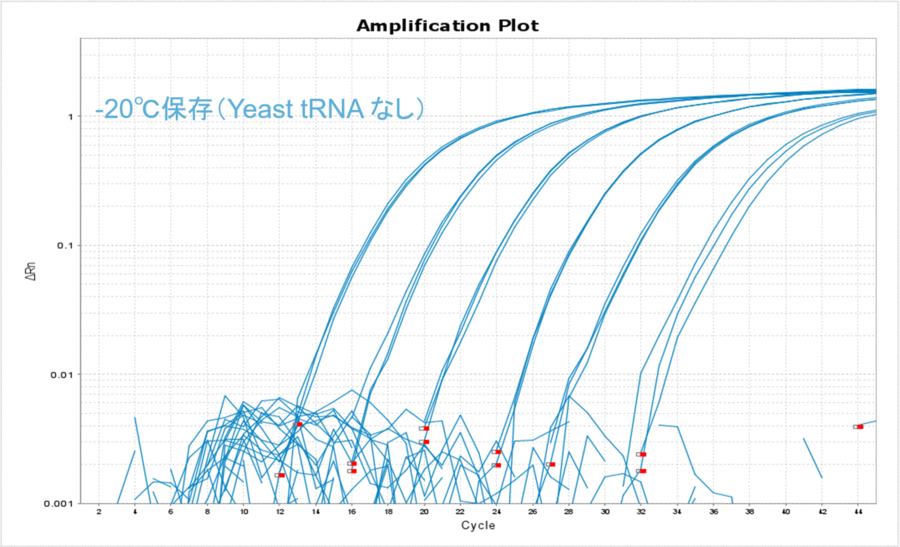
図4
核酸の保存温度は低ければよい?
最後に、-20℃保存(Yeast tRNAあり)と-80℃保存(Yeast tRNAなし)の結果を比較してみましょう。私の中のイメージでは、DNAでもRNAでも-80℃の方が安定的に凍結保存できると認識していました。もちろん、Yeast tRNAを添加しないという同じ条件であれば今回の実験結果(表1、図1)でもお示ししたように、-80℃の方が安定して保存できそうです。しかし、-80℃であってもYeast tRNAを添加しないと意外とチューブにDNAが吸着するらしく、Yeast tRNAを添加して-20℃で保存した条件の方がリアルタイムPCRで検出できるサンプル量が目減りすることはありませんでした(表5、図5)。

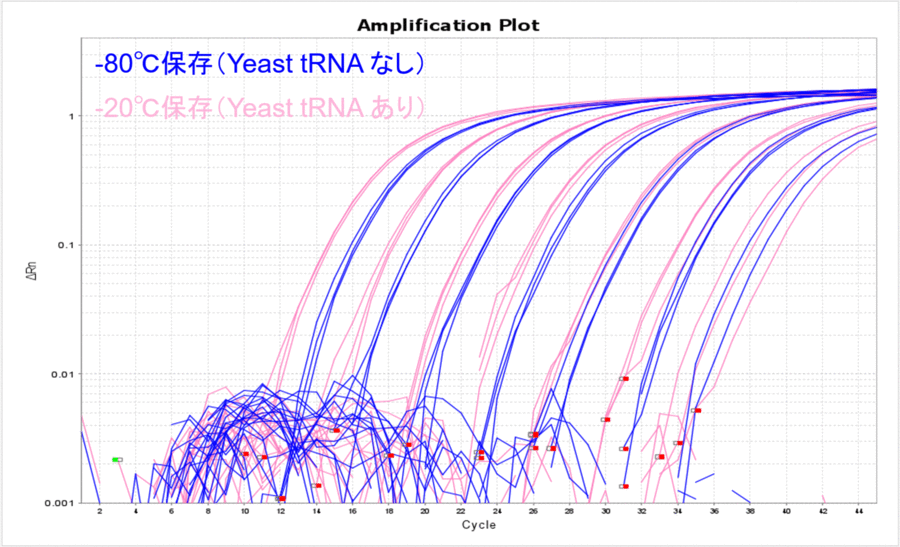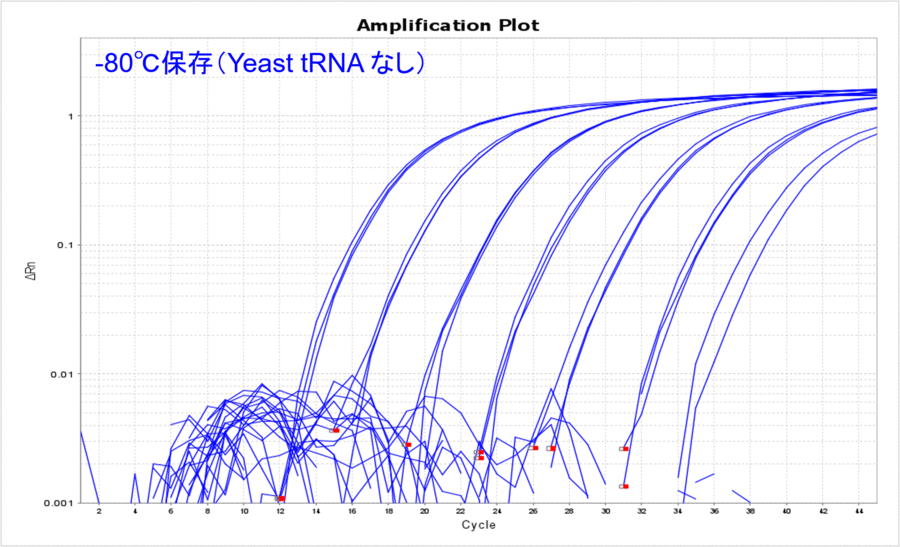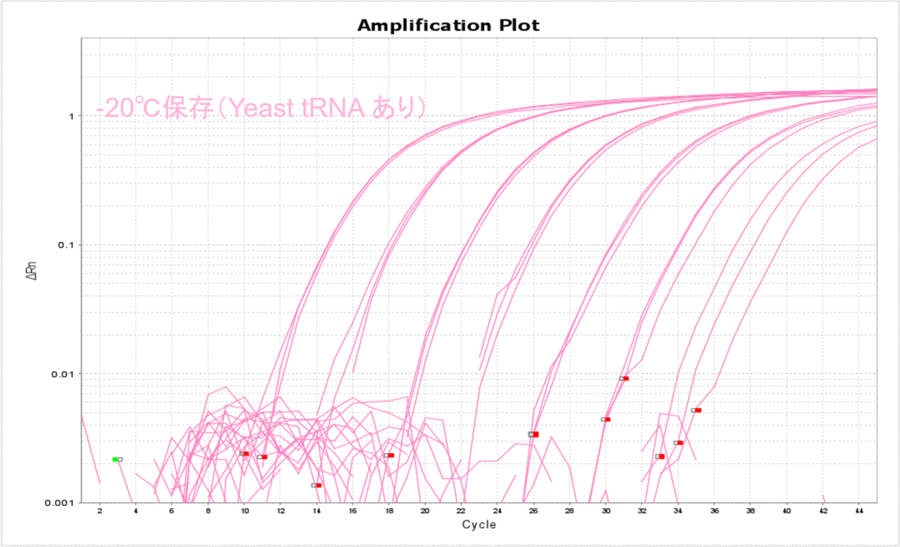
図5
Yeast tRNA はPCR反応に影響するのか?
ここまでの結果から、Yeast tRNAを添加するとDNAサンプルのチューブへの吸着を防ぐことができ、サンプルの目減りを防止できることをお示ししてきました。ひょっとしたら、Yeast tRNAを添加したから、それが原因でサンプルがかさ増しされているのでは?と思われた方もいらっしゃるでしょうか。DNAサンプルは添加せず、Yeast tRNAのみの溶媒で同様に希釈系列を作成しリアルタイムPCRを実施しました。その結果、Yeast tRNAのみではリアルタイムPCRの増幅曲線は立ち上がらず、この実験系でのPCR反応結果には影響を与えていなかったことが確認できました(図6)。

図6
最後に、内容は同じなのですが、全ての条件の結果を一覧表示した表をお示しします。-80℃のYeast tRNAありでは全ての濃度で増幅曲線が確認できましたが、-80℃のYeast tRNAなしと-20℃のYeast tRNAありでは一番薄い濃度のサンプルは増幅曲線が立ち上がらず、-20℃のYeast tRNAなしでは二番目に薄い濃度のサンプルまでも増幅曲線の立ち上がりが見られなくなってしまいました(表6)。

まとめ
いかがでしたでしょうか。
今回の実験では、DNAサンプルを長期間凍結保存すると、意外とチューブに吸着されてしまうこと、このチューブへのDNAの吸着はYeast tRNAの添加でかなり防げることをお示しできたかと思います。もちろん、今回の実験だけでは、DNAの分解とチューブへの吸着の影響を完全に切り分けられていないのですが、DNAがそれほど分解しないと考えられる-80℃保存でもYeast tRNA添加の有無ではっきりとした差が見られたことから、今回の条件ではDNAのチューブへの吸着の影響が大きかったのだろうと考えています。つまり、サンプルDNAにYeast tRNAをある程度大量に加えることで、Yeast tRNAがサンプルDNAよりも相対的に多くチューブに吸着されます。このブロッキングのような効果により、サンプルDNAがチューブに吸着してしまい目減りしてしまうことを防ぐ効果があると考えられます。ただし、Yeast tRNAは核酸ですので、下流のアプリケーションによってはご使用にならない方が良い場合もあると考えられます。ケース・バイ・ケースでご使用いただければと思います。
当社ではRNA抽出やリアルタイムPCR、他にも細胞培養、ウェスタンブロッティングなど、実際に実験(実習)を行いつつ学べる各種ハンズオントレーニングを開催しています。その中で今回のような実験結果もご紹介していますので、これから新しい実験を始められる方、より理解を深めたい方はぜひご参加ください!
研究用にのみ使用できます。診断用には使用いただけません。



