Search Thermo Fisher Scientific
顆粒球の概要
顆粒球とは?
顆粒球は、好中球、好酸球、好塩基球、および肥満細胞で構成される不均一な白血球のカテゴリーです [1]。それらは自然免疫細胞であり、活性化されると、免疫促進分子を放出してウイルスや寄生虫の感染を撃退します。顆粒球が活性化されてエフェクター機能を生み出すには、損傷、感染、またはアレルギー反応の部位にそれらを動員する炎症性シグナルが必要です。顆粒球は、ウイルスや寄生虫感染に対する反応の他に、慢性炎症、喘息、アレルギー、免疫制御、自己免疫、およびがんなどいくつかの疾患に関与しています。
顆粒球は、細胞質に分泌性の細胞傷害性顆粒が存在することを特徴とし、多形核です。顆粒球の中で最も豊富なメンバーは好中球(ヒトでは循環する白血球の約60%、マウスでは循環する白血球の約20%)であり、好酸球(循環する白血球の1~3%、骨髄中の約6%)がそれに続く一方で、好塩基球(循環する白血球の1%未満)は最もまれです。肥満細胞は主に組織に常在する細胞です。
顆粒球の種類
DAMPやPAMPに反応して病原体を貪食する殺菌性顆粒球 [2]。好中球はサイトカインを産生して他の免疫細胞を炎症部位へ動員することで免疫を調節します。
形態:未成熟な好中球は核の丸い増殖性細胞であり、初期にへこみと薄暗い細胞質を有します。成熟した細胞には、暗い多葉核があります。
存在量:好中球の存在割合は最も豊富で、、ヒトでは循環する白血球の約60%、マウスでは循環する白血球の約20%です。
寄生虫感染症やアレルギー性疾患に対する宿主反応を起こします [3]。感染時、好中球は脱顆粒により、細胞質顆粒内に保存されたカチオン性タンパク質を放出します。IL-10やIL-4などのサイトカインを放出して免疫反応を調節することができます [4]。
形態:細胞質顆粒を伴う大きな二葉核。フローサイトメトリーにおける高い側方散乱光(SSC)を特徴とします [4]。
存在量:2番目に豊富であり、循環する白血球の1~3%、骨髄で約6%を占めます。
PAMP活性化またはIgE架橋後の寄生虫に対するアレルギーと宿主反応において役割を果たします [5]。ヒスタミンを含み、IL-4など特定のサイトカインを産生する唯一の循環する白血球です。
形態:大きい細胞質顆粒。
存在量:最もまれであり、循環する白血球の1%未満。
アレルギー反応やアナフィラキシー反応に関連していますが、特に寄生虫や毒などの環境毒素に対する免疫において、保護的役割を果たすことも明らかにされています。好塩基球のように、肥満細胞は寄生虫感染やアレルゲンに反応して産生されるIgE免疫グロブリンのFc領域と結合するFcεRIを発現します。組織の修復とメンテナンスにも関与しています。
形態:密集した顆粒状の細胞質を伴う不明瞭な核 [6]。
存在量:組織内の肥満細胞の割合は低い。粘膜液中に認められる長命の組織常在性の細胞。
顆粒球の単離とフローサイトメトリー解析
顆粒球は最終的に分化した細胞であり、血液、骨髄、または組織から単離できます。フローサイトメトリーを使用して、活性化された顆粒球の集団を明らかにすることができます。細胞の単離に用いる方法は、顆粒球の非特異的活性化に大きく影響します。
好中球
好中球は、骨髄の代わりに、しばしば全血から密度勾配遠心分離により単離されます。
好酸球
ヒトとマウスの好酸球の最も入手しやすい供給源は血液である一方で、最も数多く認められるのは骨髄内です。組織に常在する好酸球は、組織に適したプロテアーゼで消化することで、ほとんどの組織から得ることができます。好酸球の別の供給源は、アレルギー性喘息モデルのマウスから得られた気管支肺胞洗浄液です。フローサイトメーターとソーターは、それらの特性評価と単離に使用できます。
好塩基球
フローサイトメーターとソーターは、好塩基球の特性評価と単離に使用できます [7]。マウス好塩基球は、IL-3の存在下で骨髄から培養することもできますが、培養条件により、得られた細胞に表現型の差異や機能的な差異が生じることが認められています。
肥満細胞
組織または腹腔から肥満細胞を単離することは労働集約的で、しばしば収率の低さに悩まされます [11]。トランスフォームされた肥満細胞株の発生がモデルとして用いられています。マウス肥満細胞を骨髄から、またはヒト肥満細胞を骨髄、臍帯血、または胎児肝臓から分化させるためのプロトコルも報告されており、通常、IL-3、SCF、またはその両方との長時間培養が必要です。しかし、これらの培養細胞は、これらの細胞が通常分化する精密な微小環境をin vitroで再現することが難しいため、組織に常在する肥満細胞の理想的な代替物にはなりません。
表1.フローサイトメトリーにより顆粒球細胞の特徴を明らかにするための顆粒球細胞マーカーの非網羅的リスト。
| 細胞サブタイプ | マーカー | 局在化 | 種 |
|---|---|---|---|
| Pan顆粒球 | CD11b | 表面 | ヒトおよびマウス |
| CD13 | 表面 | ヒト | |
| CD15 | 表面 | ヒト | |
| CD16/32 | 表面 | マウス | |
| CD32 | 表面 | ヒト | |
| CD33 | 表面 | ヒト | |
| 好中球 | エラスターゼ | 分泌 | ヒトおよびマウス |
| ラクトフェリン | 分泌 | ヒトおよびマウス | |
| IL-6 | 分泌 | ヒトおよびマウス | |
| IL-12 | 分泌 | ヒトおよびマウス | |
| TNFα | 分泌 | ヒトおよびマウス | |
| IL-1 alpha/beta | 分泌 | ヒトおよびマウス | |
| CD10 | 表面 | ヒトおよびマウス | |
| CD15 | 表面 | ヒトおよびマウス | |
| CD17 | 表面 | ヒトおよびマウス | |
| CD24 | 表面 | ヒトおよびマウス | |
| CD35 | 表面 | ヒトおよびマウス | |
| CD43 | 表面 | ヒトおよびマウス | |
| CD66a | 表面 | ヒトおよびマウス | |
| CD66b | 表面 | ヒトおよびマウス | |
| CD66c | 表面 | ヒト | |
| CD66d | 表面 | ヒトおよびマウス | |
| CD89 | 表面 | ヒトおよびマウス | |
| CD93 | 表面 | ヒトおよびマウス | |
| CD112(ネクチン-2) | 表面 | ヒトおよびマウス | |
| CD114(G-CSFR) | 表面 | ヒトおよびマウス | |
| CD116 | 表面 | ヒトおよびマウス | |
| CD157 | 表面 | ヒトおよびマウス | |
| CD177 | 表面 | ヒトおよびマウス | |
| CD181(CXCR1) | 表面 | ヒトおよびマウス | |
| CD282(TLR2) | 表面 | ヒトおよびマウス | |
| CD284(TLR4) | 表面 | ヒトおよびマウス | |
| CD286(TLR6) | 表面 | ヒトおよびマウス | |
| Ly-6G(Gr-1) | 表面 | 重要なフェノタイピングマーカー:マウス | |
| カルプロテクチン(S100A8/A9) | 表面 | ヒト | |
| CD281(TLR1) | 細胞内 | ヒトおよびマウス | |
| CD289(TLR9) | 細胞内 | ヒトおよびマウス | |
| 肥満細胞 | |||
| カテプシン | 分泌 | ヒトおよびマウス | |
| ヒスタミン | 分泌 | ヒトおよびマウス | |
| TNFα | 分泌 | ヒトおよびマウス | |
| IL-4 | 分泌 | ヒトおよびマウス | |
| TGF beta | 分泌 | ヒトおよびマウス | |
| NGF | 分泌 | ヒトおよびマウス | |
| CD9 | 表面 | ヒトおよびマウス | |
| CD15 | 表面 | ヒトおよびマウス | |
| CD24 | 表面 | ヒトおよびマウス | |
| CD35 | 表面 | ヒトおよびマウス | |
| CD43 | 表面 | ヒトおよびマウス | |
| CD64 | 表面 | ヒトおよびマウス | |
| CD116 | 表面 | ヒトおよびマウス | |
| CD117(c-kit) | 表面 | 重要なフェノタイピングマーカー:ヒトおよびマウス | |
| CD123 | 表面 | ヒトおよびマウス | |
| CD125 | 表面 | ヒトおよびマウス | |
| CD126 | 表面 | ヒトおよびマウス | |
| FceR1 | 表面 | 重要なフェノタイピングマーカー:ヒトおよびマウス | |
| IL-33R(ST-2) | 表面 | ヒトおよびマウス | |
| 好塩基球 | |||
| IL-4 | 分泌 | ヒトおよびマウス | |
| IL-13 | 分泌 | ヒトおよびマウス | |
| ヒスタミン | 分泌 | ヒトおよびマウス | |
| CCL3(MIP-1 alpha) | 分泌 | ヒトおよびマウス | |
| CD9 | 表面 | ヒトおよびマウス | |
| CD11a | 表面 | ヒトおよびマウス | |
| CD13 | 表面 | ヒトおよびマウス | |
| CD16 | 表面 | ヒト | |
| CD25 | 表面 | ヒトおよびマウス | |
| CD33 | 表面 | ヒトおよびマウス | |
| CD38 | 表面 | ヒトおよびマウス | |
| CD43 | 表面 | ヒトおよびマウス | |
| CD63 | 表面 | ヒトおよびマウス | |
| CD88(C5a受容体) | 表面 | ヒトおよびマウス | |
| CD123 | 表面 | 重要なフェノタイピングマーカー:ヒトおよびマウス | |
| CD125 | 表面 | ヒトおよびマウス | |
| CD154(CD40リガンド) | 表面 | ヒトおよびマウス | |
| CD192(CCR2) | 表面 | ヒトおよびマウス | |
| CD203c | 表面 | ヒト | |
| CD218 (IL-18R) | 表面 | ヒトおよびマウス | |
| CD282(TLR2) | 表面 | ヒトおよびマウス | |
| CD284(TLR4) | 表面 | ヒトおよびマウス | |
| CD286(TLR6) | 表面 | ヒトおよびマウス | |
| CD294(CRTH2) | 表面 | ヒトおよびマウス | |
| FceR1 | 表面 | 重要なフェノタイピングマーカー | |
| CD281(TLR1) | 細胞内 | ヒトおよびマウス | |
| CD289(TLR9) | 細胞内 | ヒトおよびマウス | |
| C/EBP alpha | 細胞内 | ヒトおよびマウス | |
| GATA-2 | 細胞内 | ヒトおよびマウス | |
| 好酸球 | |||
| MBP | 分泌 | ヒトおよびマウス | |
| EDN | 分泌 | ヒト | |
| EPX | 分泌 | ヒトおよびマウス | |
| CD9 | 表面 | ヒトおよびマウス | |
| CD15 | 表面 | ヒトおよびマウス | |
| CD24 | 表面 | ヒトおよびマウス | |
| CD35 | 表面 | ヒトおよびマウス | |
| CD43 | 表面 | ヒトおよびマウス | |
| CD64 | 表面 | ヒトおよびマウス | |
| CD116 | 表面 | ヒトおよびマウス | |
| CD123 | 表面 | ヒトおよびマウス | |
| CD125 | 表面 | 重要なフェノタイピングマーカー:ヒトおよびマウス | |
| CD126 | 表面 | ヒトおよびマウス | |
| CD170(SiglecF) | 表面 | 重要なフェノタイピングマーカー:ヒトおよびマウス | |
| CD193(CCR3) | 表面 | 重要なフェノタイピングマーカー:ヒトおよびマウス | |
| CD244 | 表面 | ヒトおよびマウス | |
| FceR1 | 表面 | ヒトおよびマウス |
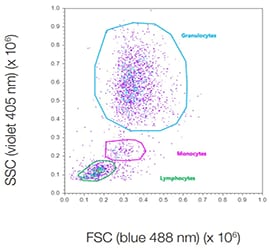
フローサイトメトリーを使用すると、顆粒球はFSC/SSCに基づく形態により、簡単に除外できます(図1)。白血球が紫色光源の散乱特性に基づいてゲーティングされると、ヒトの血液中の3つの主な白血球細胞集団(リンパ球、単球、および顆粒球)を識別できます。
顆粒球サイトカインとケモカインのプロファイリング
好中球:活性化された好中球は、IFN-gammaにより正に調節されるか、IL-10により負に調節されると、さまざまなサイトカインを産生できます。ヒト好中球は、通常、他の白血球と比べて全RNAが数分の1のため、細胞あたりでは、他の白血球よりもサイトカイン量が大幅に減少します。
好塩基球:サイトカインIL-3は、骨髄前駆細胞からの分化と好塩基球機能の活性化に関与する強力な造血増殖因子として機能します。好塩基球は、サイトカインIL-4、TSLP、IL-13、およびIL-25を産生します。これらは、Th2機能を促進でき、免疫グロブリン合成、特にIgE産生に寄与します。
好酸球:IL-5は、成熟した好酸球の発生に対して好酸球を活性化し、IL-3やGM-CSFと相乗的に作用する強力な造血増殖因子です。エオタキシン1、2、および3は、肺や腸などの体の部位に好酸球が遊走するための強力な化学誘引物質として機能します。30を超えるサイトカインが好酸球により産生されることが報告されており、いくつかは好酸球の晶質顆粒内にあらかじめ形成され貯蔵されていることが報告されています。
肥満細胞:多数の産生されたサイトカイン、ケモカイン、および増殖因子が、マウスとヒトの肥満細胞で同定されており、アレルギー性疾患、および自然免疫反応と適応免疫反応の両方を媒介します。これらのサイトカインの大部分は他の多くの細胞タイプが産生するにもかかわらず、肥満細胞によるそれらの産生は、寄生虫感染、細菌感染、ウイルス感染、食物アレルギー、およびアナフィラキシーに対する防御や粘膜部位での防御などの肥満細胞の特異的な役割に依存している可能性が高いと考えられます。
マルチプレックスイムノアッセイは、サイトカイン、ケモカイン、および顆粒球に関連する増殖因子をプロファイルするための簡便で費用対効果の高い方法を提供します。包括的なImmune Monitoring 65-Plex Human Panelは、市販の最大のマルチプレックスイムノアッセイパネルであり、顆粒球サイトカイン産生をモニタリングするための、インパクトの強い方法です。
表2:肥満細胞、好中球、好酸球、および好塩基球が産生する重要なサイトカイン。
| 肥満細胞 | 好塩基球 | 好中球 | 好酸球 | |
|---|---|---|---|---|
| サイトカイン、ケモカイン、増殖因子 | CCL1、CCL2、CCL3、CCL4、CCL5、CCL7、CCL9、CCL10、CCL17、CXCL2、CXCL8、CXCL10、TNF、IL-1 beta、IL-2、IL-3、IL-4、IL-5、IL-6、IL-9、IL-10、IL-11、IL-13、IL-16、IL-33、G-CSF、NGF、FGF、PDGF、SCF、TGF-beta 1、VEGF | IL-4、IL-13、MIP-1α、TSLP、IL-25、IL-6、CCL5、CCL3、VEGF、GM-CSF、IL-3 | TNF-alpha、IL-4、IL-10、IFN-gamma、CCL5、IL-1 alpha、IL-1 beta、IL-6、CCL3、IL-8、CXCL1、CXCL8、CXCL10、CCL2、VEGF、G-CSF、FasL、TRAIL、BAFF | CCL5、CCL3、IL-6、NGF、MBP、好酸球由来神経毒素(EDN)、EPX、IL-3、IL-4、IL-5、IL-6、IL-10、IL-11、IL-12、IL-13、IL-16、IL-17、IL-25、IFN-gamma、TNF-alpha、CCL11、CCL13、CCL17、CXCL1、CXCL5、CXCL8、CXCL10、CXCL11、CXCL9、SCF、VEGF、TGF-beta、TGF-alpha |
表3.免疫モニタリングのためのマルチプレックスイムノアッセイ。
| 種 | 概要 | 分析対象 | カタログ番号 |
|---|---|---|---|
| ヒト | Immune Monitoring 65-Plex Human Panel | G-CSF(CSF-3)、GM-CSF、IFN alpha、IFN gamma、IL-1 alpha、IL-1 beta、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8(CXCL8)、IL-9、IL-10、IL-12p70、IL-13、IL-15、IL-16、IL-17A(CTLA-8)、IL-18、IL-20、IL-21、IL-22、IL-23、IL-27、IL-31、LIF、M-CSF、MIF、TNF alpha、TNF beta、TSLP、BLC(CXCL13)、ENA-78(CXCL5)、エオタキシン(CCL11)、エオタキシン-2 (CCL24)、エオタキシン-3(CCL26)、フラクタルカイン(CX3CL1)、Gro-alpha(CXCL1)、IP-10(CXCL10)、I-TAC(CXCL11)、MCP-1(CCL2)、MCP-2(CCL8)、MCP-3(CCL7)、MDC(CCL22)、MIG(CXCL9)、MIP-1 alpha(CCL3)、MIP-1 beta(CCL4)、IP-3 alpha(CCL20)、SDF-1 alpha(CXCL12)、FGF-2、HGF、 MMP-1、NGF beta、SCF、VEGF-A、APRIL、BAFF、CD30、CD40L(CD154)、IL-2R(CD25)、TNF-RII、TRAIL(CD253)、TWEAK | EPX650-10065-901 |
| マウス | Immune Monitoring 48-Plex Mouse ProcartaPlex Panel | BAFF、G-CSF(CSF-3)、GM-CSF、IFN alpha、IFN gamma、IL-1 alpha、IL-1 beta、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-9、IL-10、IL-12p70、IL-13、IL-15/IL-15R、IL-17A(CTLA-8)、IL-18、IL-19、IL-22、IL-23、IL-25(IL-17E)、IL-27、IL-28、IL-31、IL-33、LIF、M-CSF、RANKL、TNF alpha、ENA-78(CXCL5)、エオタキシン(CCL11)、GRO alpha(CXCL1)、IP-10(CXCL10)、MCP-1(CCL2)、MCP-3(CCL7)、MIP-1 alpha(CCL3)、MIP-1 beta(CCL4)、MIP-2、RANTES(CCL5)、ベータセルリン(BTC)、レプチン、VEGF-A、IL-2R、IL-7R alpha、IL-33R(ST2) | EPX480-20834-901 |
1. de Ruiter K, van Staveren S, Hilvering B et al.(2018) A field-applicable method for flow cytometric analysis of granulocyte activation: Cryopreservation of fixed granulocytes.Cytometry A 93:540–547.
2.Hidalgo A, Chilvers ER, Summers C et al.(2019) The neutrophil life cycle.Trends Immunol 40:584–597.
3.Lee JJ, Jacobsen EA, Ochkur SI et al.(2012) Human versus mouse eosinophils: "That which we call an eosinophil, by any other name would stain as red" J Allergy Clin Immunol 130:572–584.
4.Weller PF, Spencer LA (2017) Functions of tissue-resident eosinophils.Nat Rev Immunol 17:746–760.
5.Min B, Brown MA, Legros G (2012) Understanding the roles of basophils: Breaking dawn.Immunology 135:192–197.
6.Hemmings O, Kwok M, McKendry R et al.(2018) Basophil activation test: Old and new applications in allergy.Curr Allergy Asthma Rep 18:77.
7.Mukai K, Tsai M, Starkl P et al.(2016) IgE and mast cells in host defense against parasites and venoms.Semin Immunopathol 38:581–603.
8.Fong M, Crane JS (2020) Histology, Mast Cells.In: StatPearls.Treasure Island (FL): StatPearls Publishing.
9.Orfao A, Escribano L, Villarrubia J et al.(1996) Flow cytometric analysis of mast cells from normal and pathological human bone marrow samples: Identification and enumeration.Am J Pathol 149:1493–1499.
10.Ng DP (2018) How can flow cytometry identify normal and abnormal mast cells? International Clinical Cytometry Society.
11.Meurer SK, Neß M, Weiskirchen S et al.(2016) Isolation of mature (peritoneum-derived) mast cells and immature (bone marrow-derived) mast cell precursors from mice.PloS One 11:e0158104.
12.Swieboda D, Guo Y, Sagawe S et al.(2019) OMIP-062: A 14-color, 16-antibody panel for immunophenotyping human innate lymphoid, myeloid and T cells in small volumes of whole blood and pediatric airway samples.Cytometry A 95:1231–1235.
関連記事とリソース
ナチュラルキラー細胞の概要
NK細胞は病原体に感染した細胞とがん細胞を死滅させます。また、サイトカインを放出することで、他の免疫細胞に警告し、誘引します。
免疫学のプロトコル
免疫学研究のさまざまなアプリケーションのプロトコルをご覧ください。
For Research Use Only. Not for use in diagnostic procedures.